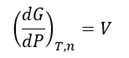
CAPíTULO II. SISTEMAS NO IDEALES
Contenido
2.1.
Fugacidad de las Sustancias Puras.
2.2.
Fugacidad y Correlaciones Generalizadas
2.3.
Fugacidad en Sistemas Multicomponentes
3.Coeficientes de Actividad para mezclas líquidas no ideales
3.2.
Coeficientes de fugacidad para Sistemas
Binarios
3.2.1. Modelo
Simétrico
3.2.2. Modelo
de Margules
3.2.3. Modelo
de van Laar
3.2.4. Modelo
de Wilson
3.2.5. Modelo
NRTL
3.2.6. Coeficientes
de Actividad de Soluciones No Ideales a partir de datos experimentales
4. Gráficas
de ELV para sistemas binarios
5. Sistemas multicomponentes no ideales
5.1. Coeficientes
de actividad por el Modelo de Wilson multicomponente
5.2. Coeficientes de actividad por el Método
de UNIFAC
5.2.1.
Procedimiento para evaluar los coeficientes de actividad por
UNIFAC
5.2.1.1.
Evaluación de los parámetros UNIFAC de mezcla
6. Estimación del ELV no ideal por UNIFAC
y Raoult modificada
Tabla No. 1. Modelo Simétrico: Mezclas
Binarias
Tabla No. 2. Modelo Margules: Mezclas Binarias
Tabla
No. 3. Modelo van Laar: Mezclas Binarias
Tabla
No. 4. Ecuación Wilson: Mezclas Binarias
Tabla No. 5. Ecuación NRTL: Mezclas
Binarias
Teniendo a la vista las relaciones de Maxwell para
la energía libre podemos observar que
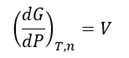
La variación de la
energía libre con respecto a cambios en la presión, cuando la masa y la
tempertura permanecen constantes en el sistema, corresponde al volumen del
sistema.
Así mismo, la
variación de la energía libre con respecto a cambios en la tempertura, a masa y
presión constantes, corresponde a la entropía del sistema
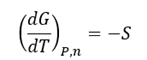
Para una mezcla
podemos expresar la energía libre como una función multivariable
![]()
en donde T, P = temperatura y presión del
sistema
n1, n2, n3,
, ni = componentes de la mezcla
La diferencial total
corresponde a
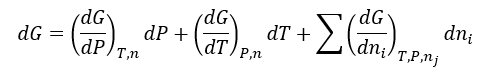
en donde ni = componente i de
composición variable
nj
= resto de componentes constantes
Se define el potencial
químico de la especie i en la mezcla como
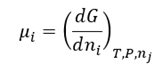
La variación de la energía libre en una mezcla multicomponente,
para una sola fase, queda expresada a través de las relaciones de Maxwell
![]()
en donde para la mezcla, cada componente aporta a G en proporción a
su fugacidad y concentración.
El criterio de equilibrio, a T y P
constantes en un sistema multicomponente de una sola fase, para que Gibbs sea
cero resulta
![]()
Si existen varias fases se plantea la ecuación de cambio de la energía
libre para cada fase
![]()
![]()
Y el cambio de la propiedad total resulta
ser
![]()
Para un sistema cerrado la condición de equilibrio
resulta
![]()
Finamente, dado que las cantidades dni son
independientes y variables, se concluye que la condición de equilibrio de
fases se da cuando
![]()
2. Fugacidad de las sustancias
El comportamiento
ideal de una sustancia se refiere al hecho que no presenta fuerzas de atracción
ni repulsión sensibles entre sus moléculas, que posee formas simétricas, no presenta
regiones cargadas electricamente, y consecuentemente son no reactivos. Los
gases ideales son una conceptulización de ese comportamiento, y como ejemplo
están los gases nobles.
La fugacidad mide el
potencial quimico de una sustancia pura y es la evaluación de cuanto se aleja
de su comportamiento ideal. El concepto aplica para cualquier fase y nace de
medir el potencial de un gas ideal cuando se hace un cambio de estado isotérmico.
De la expresión undamental
de Gibbs para una sustancia pura
![]()
A presión contante,
para un gas ideal
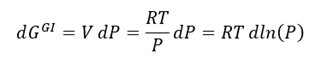
Integrando la expresión
anterior tenemos
![]()
en
donde k(T) = constante de integración función de la
temperatura
Por analogía se define
para un gas real la expresión de fugacidad (f)
![]()
Se define la fugacidad
del gas real como su presión parcial que es equivalente a la presión del gas
ideal a la misma temperatura y energía libre molar de Gibbs. De tal
forma que la fugacidad de un gas ideal corresponde a su presión
![]()
Se puede crear una
función llamada Propiedad Residual (MR) que es la variación
entre el comportamiento como gas ideal y el gas real, siendo
![]()
Atendiendo a la
anterior deifinición tenemos que la energía de Gibbs residual es
![]()
donde ![]() es el coeficiente de fugacidad
es el coeficiente de fugacidad
Por otro lado, para
una mezcla gaseosa tenemos las relaciones
![]()
![]()
La energía de Gibbs
residual en la mezcla para la especie i es
![]()
donde ![]() es el coeficiente de fugacidad de la especie i
en la mezcla.
es el coeficiente de fugacidad de la especie i
en la mezcla.
Retomando la expresión
fundamental de Gibbs para una sustancia pura, rearreglando y aplicando para el
caso residual tenemos
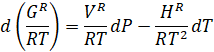
Teniendo presente para
un gas real usando el factor de compresibilidad
![]()
Integrando la
expresión de Gibbs residual y a T constante
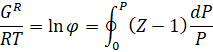
2.1.
Estimación de
la fugacidad en sustancias puras
Las fugacidades pueden ser calculadas a partir las propiedades y funciones de estado, tanto para la fase líquida como vapor.
En tal sentido, se puede estimar la fugacidad en fase vapor de una sustancia pura si se conoce la temperatura, presión, entalpía y entropía para un estado determinado, calculando la variación entre esas condiciones y un estado de referencia (°)
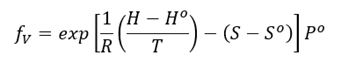
Por otra parte, para evaluar la fugacidad en fase líquida se debe conocer la presión y volumen de saturación, además de la presión y temperaturas de la sustancia en ese punto
![]()
en donde
![]() es el coeficiente de fugacidad en saturación de la sustancia pura que se evalúa como la relación entre la fugacidad
del vapor y la presión de saturación en el punto de cambio de fase
es el coeficiente de fugacidad en saturación de la sustancia pura que se evalúa como la relación entre la fugacidad
del vapor y la presión de saturación en el punto de cambio de fase
![]()
Este coeficiente de fugacidad para una sustancia
pura ideal vale uno.
Para la fase vapor el coeficiente de fugacidad es
la relación entre fugacidad y presión del sistema (que para una sustancia pura
es igual a la presión del vapor)
![]()
Para la fase liquida el coeficiente de fugacidad es
la relación entre la fugacidad y la presión de vapor, entendida esta como una
propiedad del líquido y función de la temperatura
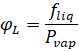
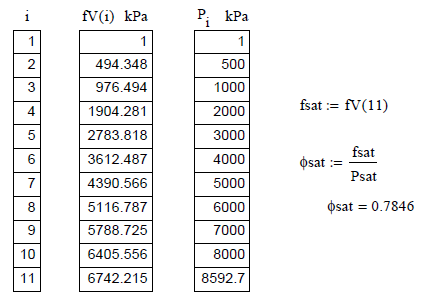
Ilustración. Determinar
el coeficiente de fugacidad para el agua, en un intervalo de presión entre 1
kPa hasta 5.0 MPa. Se tiene la siguiente información de saturación y cambio de
fase:

Completando
la información de la Tablas de Vapor Sobrecalentado del agua

La fugacidad del vapor de una sustancia pura
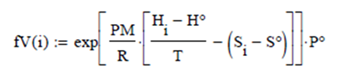
Hallando la fugacidad de la fase vapor para cada
punto de los datos dados, al comparar los valores obtenidos contra la presión
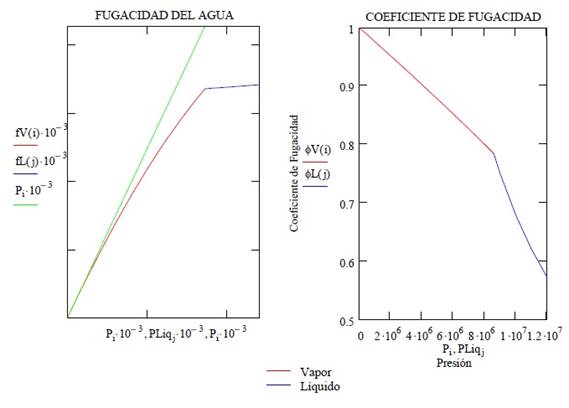
vemos que al aumentar ésta, la aproximación a la idealidad disminuye
sensiblemente, ya que el vapor se va aproximando al punto de saturación y
posterior condensación.
El coeficiente de fugacidad en saturación se
obtiene con la presión de saturación, en el último punto de los datos.
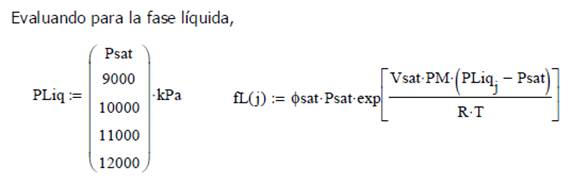
Se muestra la gráfica de fugacidades de fase contra la presión y atendiendo que
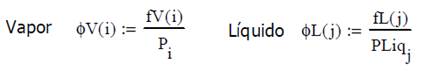
También se incluye la gráfica de los coeficientes de fugacidad de fase contra la presión. Ambas gráficas corresponden a T constante.
2.2. Coeficientes de Fugacidad utilizando Correlaciones Generalizadas
Debemos recordar en primer lugar, las correlaciones de Pitzer, definidas en la sección 1.1.1. del capítulo 1, para evaluar los dos primeros coeficientes viriales

Cuando la forma sencilla de la ecuación virial es válida, resulta una correlación generalizada particularmente simple para evaluar ln φ.
Para ello, las ecuaciones anteriores se combinan
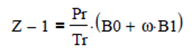
siendo ω el
factor acéntrico ![]()
De la definición del logaritmo del Coeficiente de Fugacidad, previamente mostrada, y arreglando la expresión se obtiene
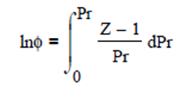
Esta ecuación, empleada con las ecuaciones de los dos primeros coeficientes viriales, brinda valores dignos de confianza para gases no polares o ligeramente polares, si se aplica a las condiciones de Z como función lineal de la presión

Tenemos
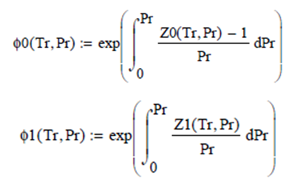
Ilustración. Para el 1-buteno a 200C y 70 bar
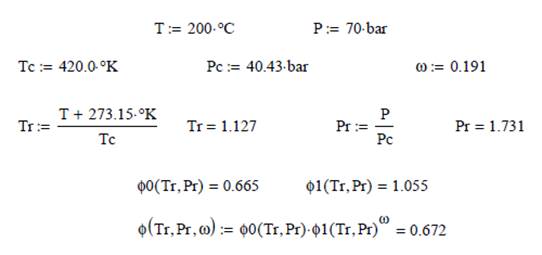
Nota: Analice el error introducido por las correlaciones generalizadas con respecto al uso de los valores de Z0 y Z1 de Lee-Kesler.
Graficando para el rango de presión reducida Pr = (0.2,..., 10) para la temperatura reducida Tr = 1.6
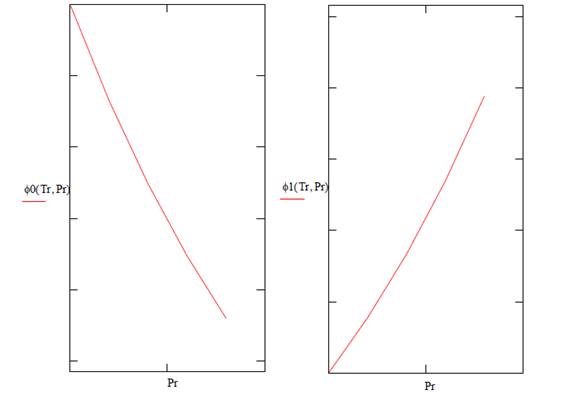
2.3. Coeficiente de Fugacidad en Mezclas gaseosas utilizando Correlaciones Generalizadas
Para mezclas, la evaluación de los coeficientes de cada componente deberá hacerse relacionando las propiedades críticas de cada sustancia para una presión y temperatura dadas.
A partir de las fórmulas de mezclado propuestas por Smith et al (2018) cuya aplicación se muestra en la ilustración siguiente, se calculan las propiedades críticas de mezcla, ponderando cada una de las propiedades críticas de las sustancias presentes con las fracciones molares en el vapor.
Posteriormente se evalúan los coeficientes viriales de mezcla y de allí se obtienen los coeficientes de fugacidad en mezcla utilizando esos coeficientes viriales y las propiedades de estado del sistema.
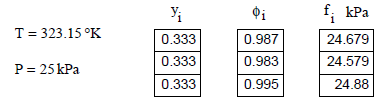
Ilustración. Evaluar los coeficientes de fugacidad para la mezcla gaseosa Metil-etil-cetona MEC con Tolueno y Agua, para las siguientes condiciones
T = 50 + 273.15 K y P = 25 kPa

Evaluación de las propiedades de mezclado, asumiendo el parámetro de ajuste de la temperatura de mezcla K = 0


La fórmula para el Coeficiente de fugacidad en mezcla fase vapor
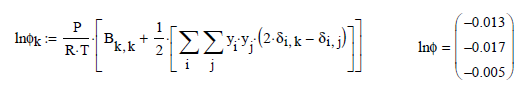
La fugacidad y los coeficientes de fugacidad en mezcla
φk = exp(ln φk) y fk = φk⋅P
2.4.
Cálculo
del Factor PHI de fugacidad para determinar el equilibrio líquido vapor
El Factor PHI (Φ) se utiliza para evaluar el ELV en mezclas multicomponentes no ideales, y se obtiene evaluando los coeficientes de fugacidad en mezcla y adicionando la fugacidad de la fase vapor en condiciones de saturación de equilibrio.
Se calcula, para cada componente, a partir de la siguiente relación
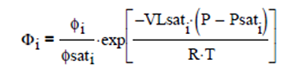
En muchas ocasiones se puede simplificar el término exponencial conocido como Factor de Pointing, ya que a bajas y moderadas presiones difiere muy poco de la unidad, en cuyo caso tenemos
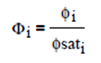
De ser el caso, se puede evaluar el coeficiente de fugacidad en mezcla utilizando la ecuación virial hasta su segundo factor, reportando adecuados resultados, que corresponde a la expresión evaluada en la sección anterior:
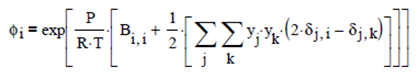
Por otra parte, el coeficiente de fugacidad para sustancias puras en condiciones de vapor saturado se expresa por
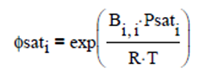
Combinando ambas expresiones, se obtiene el Factor PHI de fugacidad
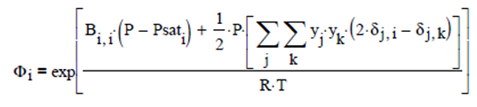
Se presenta un ejemplo aplicando este sistema de ecuaciones.
Ilustración. Evaluar los coeficientes PHI de fugacidad para la mezcla gaseosa MEC-Tolueno-Agua, a las siguientes condiciones


3.
Propiedades
de las mezclas líquidas no ideales
3.1. Propiedades en exceso para mezclas
líquidas no ideales
Las propiedades en exceso se definen como la diferencia entre el valor real de una propiedad en una solución real y el valor que tendría si se tratara de una solución ideal. En general si M es esa propiedad
![]()
Por ejemplo,
![]()
Entonces
![]()
Ilustración. Para una solución equimolar de benceno (1) y n-hexano (2) a 323.15 K.
Se conocen las
siguientes propiedades en exceso para T0 = 298.15 K
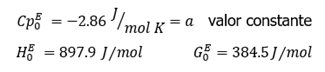
De las relaciones de
Maxwell tenemos
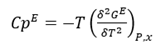
Por lo tanto
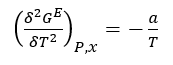
Integrando
![]()
Volviendo a integrar
![]()
También, de las
relaciones de Maxwell
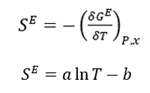
Dado que HE
= GE + TSE, al combinar ecuaciones obtenemos
![]()
Las constantes se
pueden evaluar a partir de los datos dados

Finalmente, para
T=323.13 K
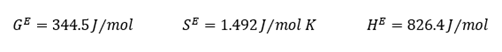
Relacionando las definiciones de propiedad residual y propiedad en exceso
![]()
se llega a la siguiente expresión
![]()
Es de notar que las propiedades en exceso no tienen significado para especies puras, mientras que las propiedades residuales aplican tanto para especies puras como para mezclas.
3.2.
Coeficientes
de Actividad para mezclas líquidas no ideales
Por analogía al
tratamiento realizado para mezclas de gases, también para mezclas líquidas
tenemos las relaciones para los casos ideal y real, respectivamente
![]()
![]()
en donde Gi = energía
libre de la sustancia i en la mezcla real
GiSI = energía libre de la sustancia i en la solución ideal
xi = fracción molar de i en la solución
fi = fugacidad de la sustancia i pura
fi^ = fugacidad de la sustancia i en mezcla
La energía de Gibbs en exceso en la solución para la especie i es
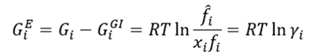
donde ϒi es el coeficiente de actividad de la especie i en la solución.
Para calcular los coeficientes de actividad que evalúan el grado de no idealidad de una mezcla líquida real existen varios criterios. Todos ellos se basan en determinar la energía libre de Gibbs en exceso de la solución.
3.2.1. Sistemas líquidos binarios
También llamado modelo de Porter se basa en la definición de la energía libre en exceso
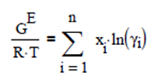
Aplicando esa expresión para un sistema binario, se requiere como condición para el equilibrio que GE = 0 y esto se consigue cuando x1 = 0 y x2 = 0, puesto que la fugacidad siempre tiene un valor.
Para que se den esas condiciones, el polinomio más
simple que cumple con ese requisito y que expresa la energía libre en exceso de
Gibbs para un sistema binario corresponde a
![]()
siendo A una constante de proporcionalidad.
El modelo simétrico sugiere, acondicionando la expresión anterior con una nueva constante B, que
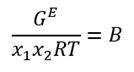
A partir de la definición de los coeficientes de actividad en una dilución se tiene
![]()
Además, los parámetros a dilución infinita son simétricos
![]()
Ilustración [Sandler/Fig. 7.5-2]. Dado el Sistema Binario Acetona (1) / Metanol (2) de tipo simétrico a 320 K, el valor de la constante se obtiene de la tabla No. 1 del anexo de este capítulo
B = 0.56
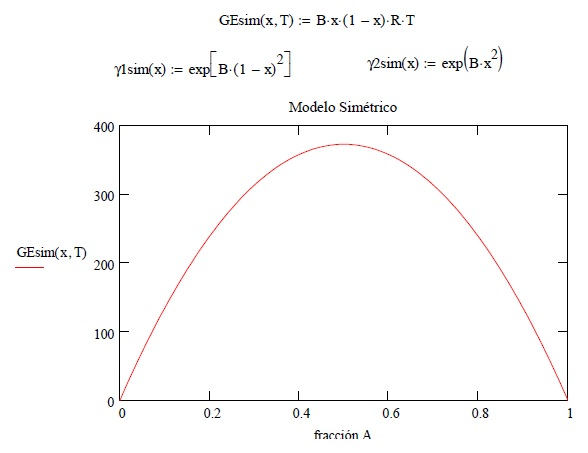
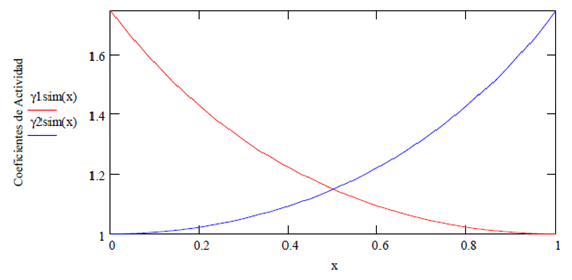
Se aprecia claramente en este modelo la simetría del mismo.
Modelos Asimétricos en sistemas binarios
Modelo de Margules de dos constantes. Este modelo establece que
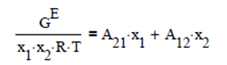
Los coeficientes de actividad quedan definidos así

De tal forma que
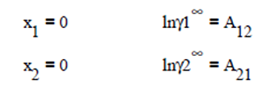
Ilustración. Para el sistema binario de la ilustración anterior, Acetona
(1) / Metanol (2) a 320 K, el valor de
las constantes se obtiene de la tabla No. 2 del anexo de este capítulo
A12 = 0.579 y A21 = 0.618
El sistema de ecuaciones queda
planteado de la siguiente forma
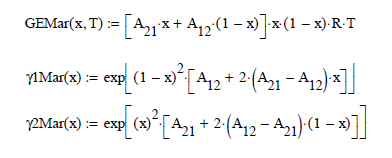
Además, para fracciones molares igual
a la unidad
![]()
La primera gráfica corresponde a la energía libre en función de la composición de x1 y la temperatura del sistema. La segunda gráfica muestra los valores del logaritmo natural de ambos coeficientes de actividad en función de x1
Modelo Margulles
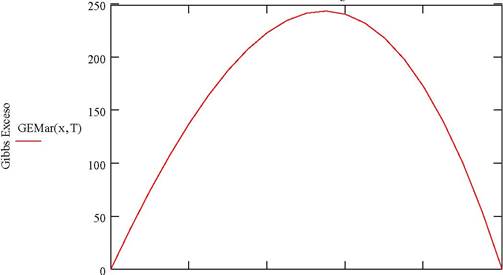
x
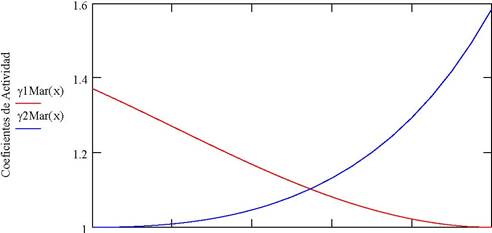
x
A diferencia del modelo anterior, la asimetría o no idealidad del modelo se hace notoria.
Modelo de Van Laar (1930), propone para evaluar los Coeficientes de Actividad, para un sistema líquido binario, las siguientes ecuaciones
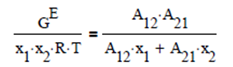
en donde A12 y A21 son parámetros de interacción molecular entre las dos especies en mezcla
Las expresiones para los logaritmos de los coeficientes de fugacidad son
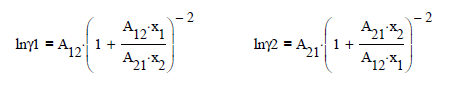
Los valores extremos corresponden a
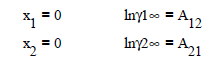
Ilustración. Para el sistema binario de la ilustración anterior, Acetona
(1) / Metanol (2) a 320 K, el valor de
las constantes se obtiene de la tabla No. 3 del anexo de este capítulo

Las gráficas respectivas de la energía libre en función de la composición de x1 y la temperatura del sistema, y del logaritmo natural de ambos coeficientes de actividad en función de x1 se muestran seguidamente.
Modelo Van Laar
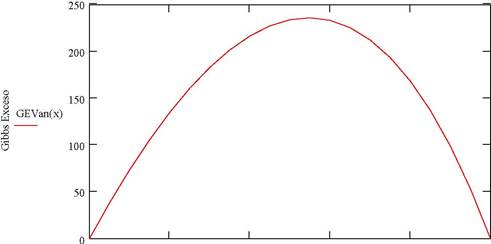
x1
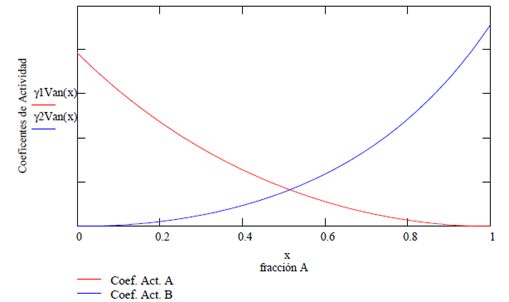
Modelo de Wilson (1964). Introduce este modelo el concepto de composición
local que, en una solución liquida toma en cuenta el ordenamiento de corto
alcance y orientaciones moleculares no al azar, debido a las diferencias en los
tamaños moleculares y a las fuerzas intermoleculares.
Este modelo propone para evaluar los
Coeficientes de Actividad, para un sistema liquido binario, las siguientes
ecuaciones:
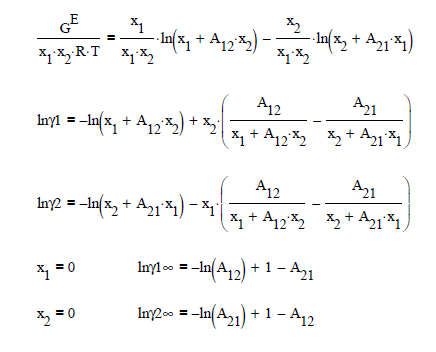
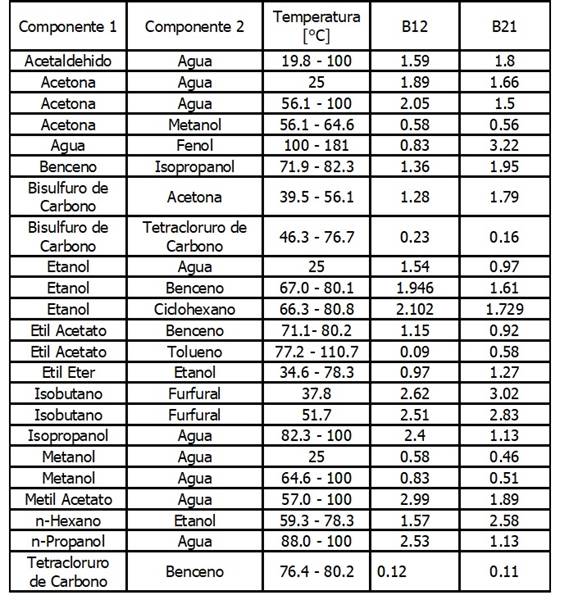
Ilustración. Para el sistema binario de la ilustración anterior, Acetona
(1) / Metanol (2) a 320 K, el valor de
las constantes se obtiene de la tabla No. 4 del anexo de este capítulo
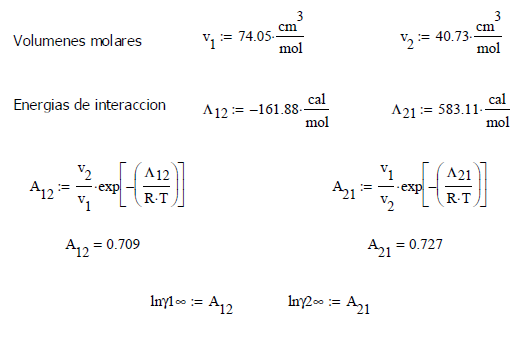
La
expresión de la energía libre en exceso en función de la composición de x1
es la siguiente
![]()
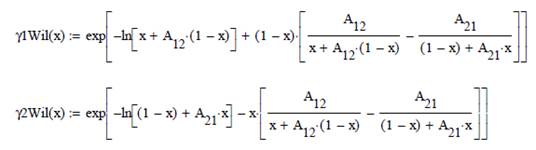
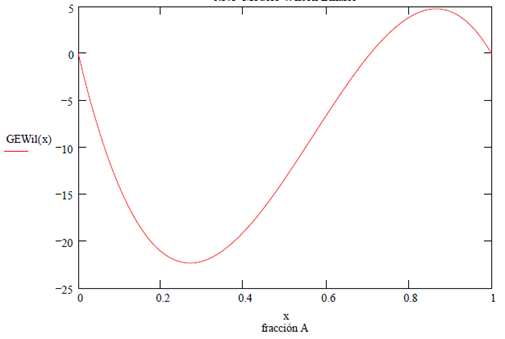
Las
gráficas resultantes son
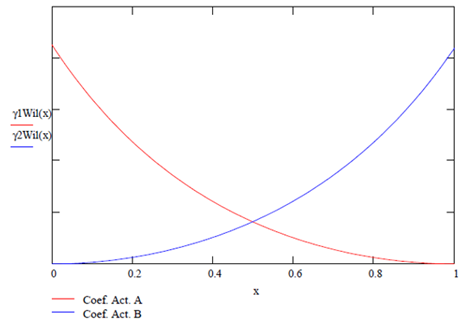
Modelo NRTL -Non random two liquids- (1968). Este modelo -Dos Líquidos No al Azar, en inglés- utiliza el mismo concepto de Wilson.
Es una ecuación de tres parámetros, similar al Método UNIQUAC que se explica más adelante, es aplicable a ambos equilibrios Líquido - Vapor y Líquido - Líquido.
Propone para sistemas líquidos binarios la energía libre en exceso como
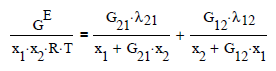
Y las expresiones de los coeficientes de actividad para cada especie
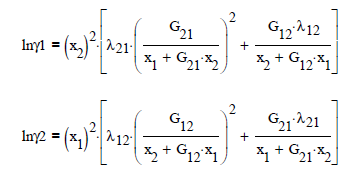
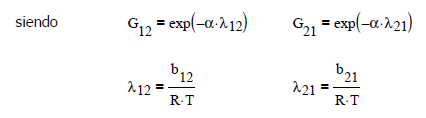
en donde α, b12 y b21 son parámetros específicos entre pares de componentes, independientes de la presión y temperatura.
Además, los valores de los coeficientes de actividad
para dilución infinita están dados por las ecuaciones
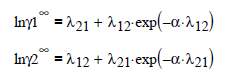
Ilustración. Para el mismo sistema anterior,
Acetona (1) /Metanol (2), extrayendo las constantes de la tabla No. 5 del final del capitulo
Se utiliza para sistemas binarios miscibles el
valor α = 0.3084
Y las constantes de forma y de energía de
interacción molecular
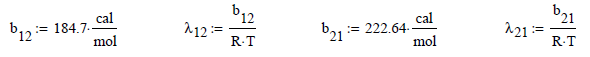
Los
parámetros de energía son
![]()
Obteniéndose
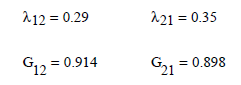
La
energía libre en exceso integra todas esas variables
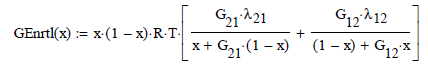
Las
expresiones de los coeficientes de fugacidad en función de x1 son
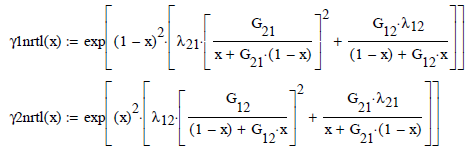
Las
expresiones de los coeficientes de actividad para dilución infinita están dadas
por las ecuaciones
![]()
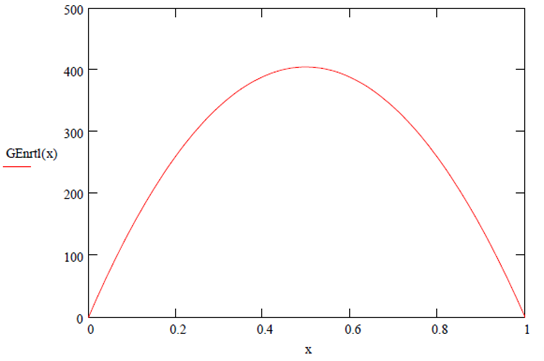
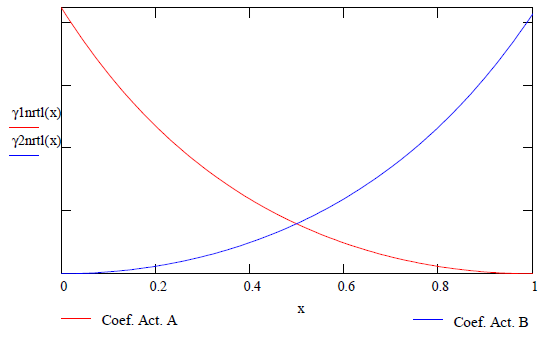
Las
gráficas correspondientes se muestras a continuación. Es de notar que reflejan
una tendencia simétrica.
3.2.6. Evaluación de Coeficientes de Actividad de Soluciones Binarias No Ideales a partir de datos experimentales
Utilizando información experimental
sobre el Equilibrio Liquido Vapor, que incluya datos de composición en fase
liquida y fase vapor y presiones para cada punto, es posible evaluar los
coeficientes de actividad para cada componente del sistema.
Este método es restrictivo para sistemas
binarios, sin embargo, su funcionalidad lo hace de mucha utilidad.
Se aplica un criterio estadístico para
encontrar los valores de los coeficientes a dilución infinita, que servirán
como parámetros para sustituir en los valores respectivos de cualquiera de los
modelos propuestos anteriormente
Se desarrolla el método a través de una
ilustración.
Ilustración. Evaluar los coeficientes de actividad
en mezcla de acetona (1) y cloroformo (2), dada la siguiente información
experimental para el sistema
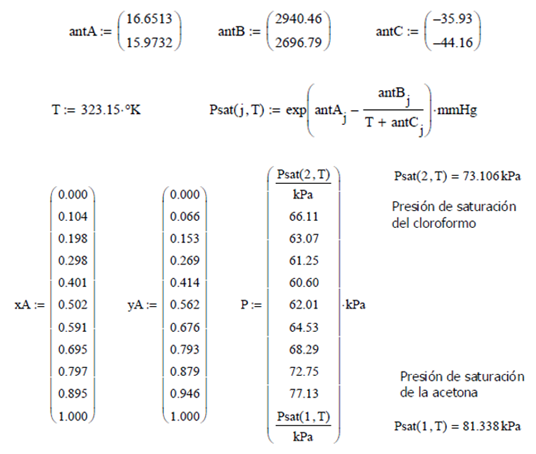
La relación entre una mezcla de gases
ideales y su correspondiente solución real, da origen
al coeficiente de actividad del sistema, aplicando la ecuación de Raoult
Modificada.
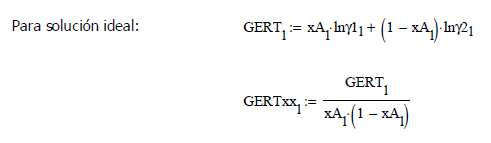
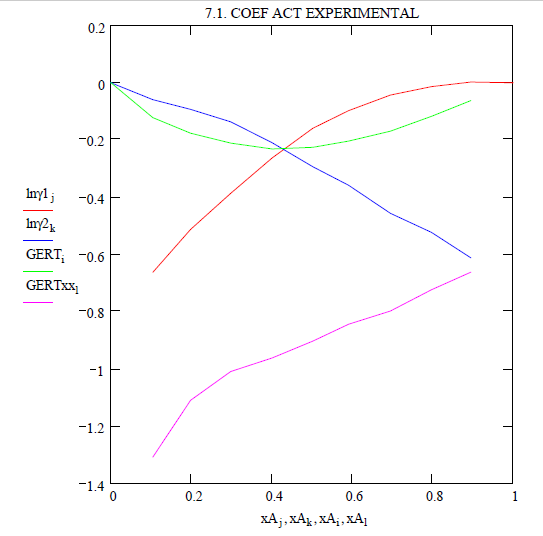
Con la información
experimental disponible en forma gráfica, se procede a encontrar una correlación
lineal con los datos obtenidos para la expresión de Gibbs en Exceso.
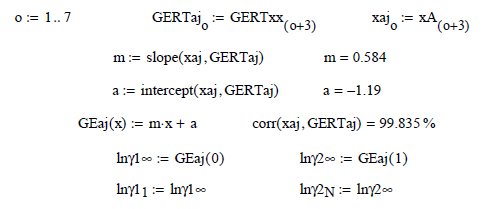
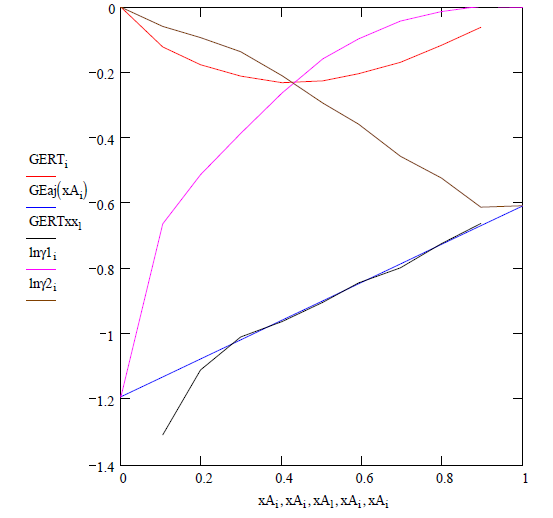
Siendo los parámetros a dilución
infinita:
![]()
A partir de estos valores se puede utilizar
cualquiera de los modelos binarios propuestos para establecer a cuál pertenece
la data disponible.
4.
Gráficas
ELV no ideales en Sistemas Binarios
Para el mismo sistema acetona (1) y cloroformo (2) las expresiones de la presión de vapor son
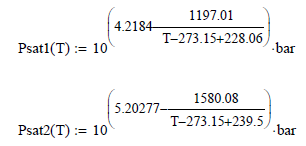
Modelo Simétrico
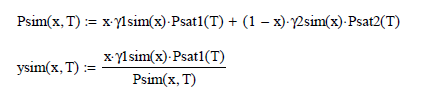
Modelo Margules
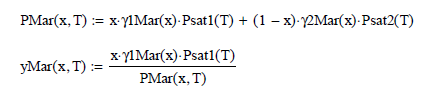
Modelo van Laar binario
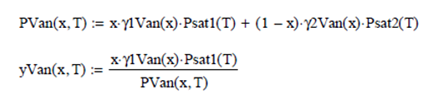
Modelo Wilson Binario
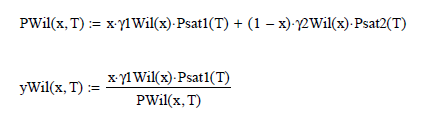
Modelo NRTL binario
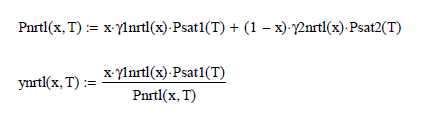
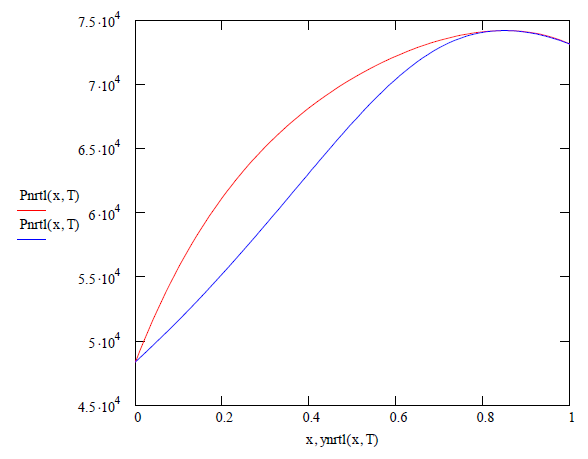
Graficando cada modelo con sus parámetros
correspondientes se puede comprobar que, para este sistema ejemplificado, las
correspondientes gráficas de presión contra fracción molar de componente x1
para ambas fases.
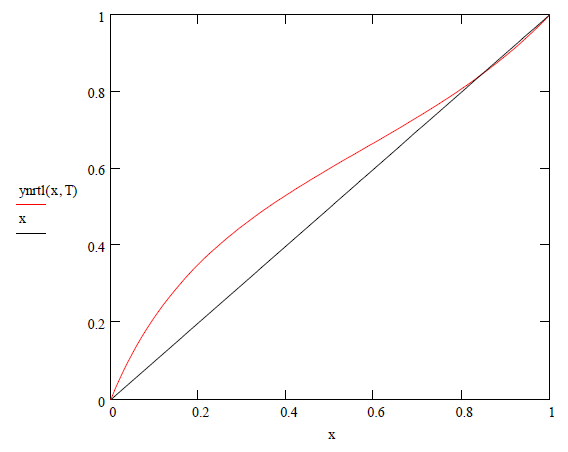
El
sistema ejemplificado presenta un punto azeotrópico en el diagrama de
concentraciones x1 y1, para el valor de xAZET = 0.84
5.
Sistemas multicomponentes no ideales
Los sistemas multicomponentes se comportan de tal
forma que las propiedades del sistema, como el volumen, no resultan ser exactamente
la suma de las propiedades individuales de cada componente.
Por ejemplo, si se mezclan 1/2 litro de agua con otro
1/2 litro de alcohol etílico, el resultado esperado sería un litro. En la
práctica no es así. El volumen ideal de la solución sería un litro, pero el
volumen experimental es de aproximadamente 0.86 litros.
Esta diferencia da origen a las propiedades en
exceso ya mencionadas, y a la definición de las propiedades parciales molares
que se definen en el siguiente capítulo.
Por otra parte, para determinar el equilibrio
líquido vapor en estos sistemas no ideales es necesario recurrir a modelos
desarrollados para calcular los coeficientes de actividad de la mezcla y a
partir de allí calcular las condiciones del equilibrio.
Estos modelos utilizan varias reglas de mezclado de
los componentes entre sí, basadas en estimaciones las interrelaciones
moleculares teóricas y ajustados con datos experimentales que han permitido
cálculos muy precisos para el ELV no ideal.
5.1.
Coeficientes de actividad por el Modelo de
Wilson multicomponente
Los modelos de la energía libre de Gibbs para mezclas
binarias pueden ser extendidas para mezclas multicomponentes, y la forma de la
ecuación de Wilson queda expresada así
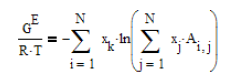

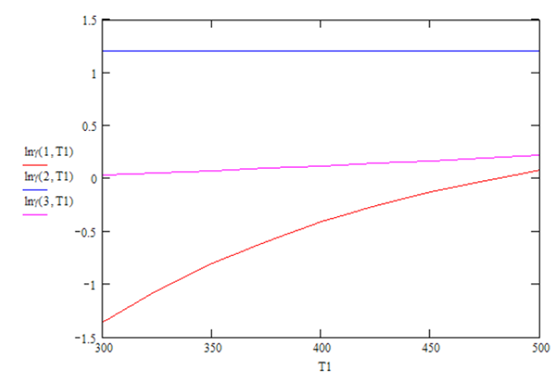
Ilustración. Para el sistema Acetona
(1) / Agua (2) / Metanol (3), se desea aplicar el Modelo Wilson para evaluar
los coeficientes de actividad, se gún la siguiente información
Asumiendo composición
de la mezcla liquida constante
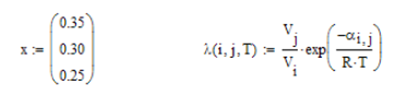
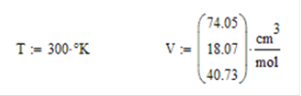

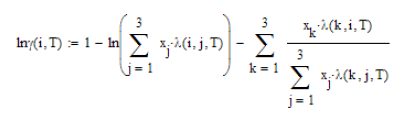
5.2. Coeficientes de actividad por el Método UNIFAC
Este modelo constituye actualmente el método estandarizado más adecuado para evaluar los coeficientes de actividad de mezclas líquidas no ideales, que facilitan la estimación del Equilibrio Líquido Vapor para sistemas no ideales.
Fue desarrollado por Abrams y Prausnitz en 1975, tomando en cuenta las interacciones moleculares y la forma y tamaño de las moléculas presentes de cada componente en el sistema. Es especialmente útil para evaluar el comportamiento de soluciones conformadas por compuestos orgánicos.
Se base en el concepto de que en una mezcla líquida las propiedades de la solución están determinadas por las propiedades de las especies presentes, pero no consideradas como estructuras moleculares integradas sino como grupos funcionales determinados que estructuran cada molécula en la solución.
Estos grupos UNIFAC coinciden en buena parte con los grupos que se definen en la química orgánica, sin embargo, tienen algunas variaciones en su definición.
Por su parte, el coeficiente de actividad en mezcla se evalúa en términos de la energía libre en exceso, es decir, la energía "extra" requerida por la solución y no la diferencia de la solución ideal. Este coeficiente muestra la no idealidad en el comportamiento de la sustancia y se incorpora a la ecuación de Raoult Modificada para calcular el equilibrio líquido vapor.
Se define por la expresión
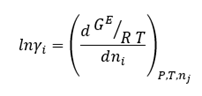
Este coeficiente se puede evaluar a partir del cambio de la energía libre en exceso de la solución al variar la concentración de la especie i manteniendo constantes la presión y temperatura del sistema y constantes las concentraciones de las demás especies.
La ecuación para estimar la desviación de la idealidad en el equilibrio que propone el modelo UNIFAC es la siguiente
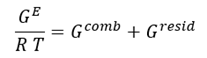
en donde Gcomb es la energía combinatoria por la forma y tamaño molecular
Gresid es la energía residual las interacciones moleculares
A partir de la anterior expresión, se definen los coeficientes de actividad evaluados por UNIFAC
![]()
Ambas energías combinatoria y residual son evaluadas a través del uso de parámetros específicos para cada especie presente, definidos por UNIFAC sobre el volumen molecular relativo rj, el área molecular relativa qi y tomando en consideración el parámetro de interacción molecular aij evaluado en forma binaria por pares de especies en la solución.
Estos parámetros se obtienen al definir las unidades funcionales que conforman una molécula y que interactúan entre sí, confiriendo las características propias de cada especie química en mezcla. A cada unidad funcional se le asocia un volumen relativo (Rk) y un área superficial relativa (Qk) y se considera además el efecto interacción energética, la energía de asociación (αi,j) entre ellas cada unidad funcional.
Los grupos funcionales UNIFAC tienen similitud con los grupos funcionales de la química orgánica pero no son los mismos, como se apuntó anteriormente. Se definen en base a los criterios: alcanos, alquenos, aromáticos, etc. Y se han agregado otros grupos específicos como los halogenuros, sulfuros y otros, totalizando 50 grupos principales, cada uno de ellos identificado por un número principal NP del 1 al 50.
A su vez, cada grupo principal está clasificado en subgrupos funcionales en base al grado de sustitución y el tipo de enlace del carbono principal que lo integra. Se han definido 108 subgrupos, identificados como NS del 1 al 108.
Se muestran algunos ejemplos de grupos principales y subgrupos
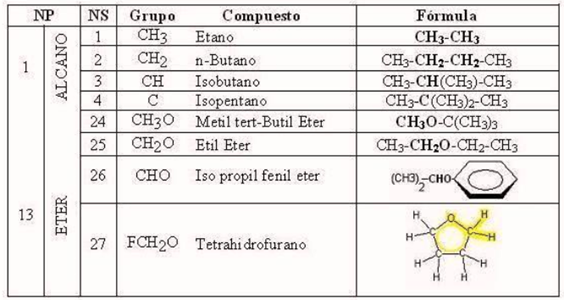
Para el cuadro anterior tendríamos los siguientes valores de los parámetros
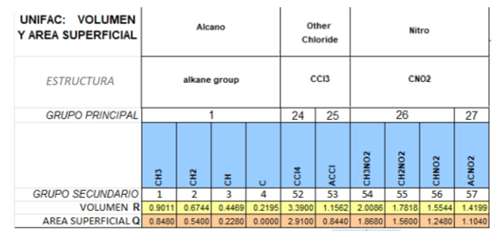
Se incluye en Excel la tabla completa de grupos y subgrupos funcionales con los valores de los volúmenes relativos (Rk), las áreas superficiales relativas (Qk) y energía de asociación entre grupos (αi,j).

5.2.1. Procedimiento
para evaluar los coeficientes de actividad por UNIFAC
Para evaluar los coeficientes de actividad en una mezcla por el Modelo UNIFAC se sigue los siguientes pasos:
1. Para el sistema dado se procede a descomponer cada especie presente en sus respectivos grupos funcionales
2. A continuación, se determinan los parámetros de área y volumen relativos y la interacción energética de cada uno los grupos presentes para cada especie presente en la mezcla
3. Se determina la frecuencia de cada uno de estos parámetros
4. Se aplican la serie de fórmulas de reparto en el mezclado que relacionan los parámetros individuales entre grupos para establecer las relaciones entre las especies presentes
5. Se evalúa la parte combinatoria y la parte residual de la fórmula para obtener los coeficientes de actividad en mezcla.
Se muestra el procedimiento con un ejemplo.
Ilustración.
Evaluar los parámetros de mezcla para una mezcla no ideal de n-hexano (1) /
etanol (2) / metilciclopentano (3) y benceno (4) a la
siguiente composición molar
x1 = 0.162, x2 = 0.068, x3
= 0.656 y x4 = 0.114
Se deben desarrollar las fórmulas moleculares de los
componentes, en base a los grupos funcionales UNIFAC
n-hexano (1) (CH3)2-(CH2)4
etanol (2) (CH3)-(CH2)-(OH)
mcp (3) (CH2)4-(CH)-(CH3)
benceno (4) (ACH)6
Luego, de
la tabla de parámetros UNIFAC se extraen los valores por subgrupo de Qi, Ri y se
construye la matriz de frecuencia (νi)
de los grupos secundarios presentes por componente
|
GS\C |
Qi |
Ri |
|
νi,j |
|||
|
(1) |
(2) |
(3) |
(4) |
||||
|
CH3 |
2 |
1 |
|
2 |
1 |
1 |
0 |
|
CH2 |
4 |
1 |
|
4 |
1 |
4 |
0 |
|
CH |
0 |
0 |
|
0 |
0 |
1 |
0 |
|
ACH |
0 |
0 |
|
0 |
0 |
0 |
6 |
|
OH |
0 |
1 |
|
0 |
1 |
0 |
0 |
La matriz de parámetros de energía de interacción de
grupos αi,j
|
GS |
CH3 |
CH2 |
CH |
ACH |
0H |
|
CH3 |
0 |
0 |
0 |
61.13 |
986.5 |
|
CH2 |
0 |
0 |
0 |
61.13 |
986.5 |
|
CH |
0 |
0 |
0 |
61.13 |
986.5 |
|
ACH |
-11.12 |
-11.12 |
-11.12 |
0 |
636.1 |
|
OH |
156.4 |
156.4 |
156.4 |
89.6 |
0 |
5.2.1.1. Evaluación de los parámetros UNIFAC de mezcla
Existen varias fórmulas de mezclado que combinan los volúmenes y áreas de grupos con los parámetros de energía, las frecuencias de subgrupos y fracciones de las especies presentes.
Los volúmenes moleculares relativos para cada componente de la mezcla son los valores ponderados del volumen de grupo funcional por su frecuencia en el componente, siendo ng el número de grupos funcionales presentes
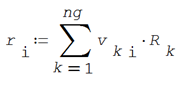
Las áreas moleculares relativas para cada componente de la mezcla son los valores ponderados de las superficies relativas de cada grupo funcional por su frecuencia en el componente
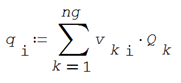
El volumen fraccional de reparto de cada componente se evalúa como la relación entre el volumen molar relativo de cada componente entre esos volúmenes ponderados por la concentración
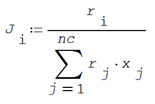
El área fraccional de reparto de cada componente se evalúa como la relación entre el área molecular relativa de cada componente por las áreas ponderados por la concentración
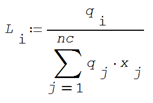
El área parcial de grupo funcional es el producto de las áreas funcionales de cada grupo funcional por la frecuencia de grupo por componente
![]()
El área relativa por componente es el producto de las áreas parciales de grupo funcional por la fracción molar de cada componente
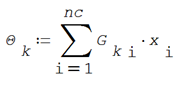
La energía funcional de mezcla se evalúa con la siguiente expresión que relaciona la energía de asociación entre grupos y la temperatura del sistema
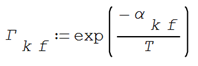
Y la energía parcial molar como el producto del área parcial de grupo funcional por la energía funcional de mezcla
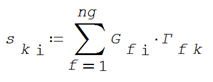
El último parámetro corresponde a la energía de mezcla por componente la cual se obtiene ponderando la energía parcial molar por la fracción molar de cada compuesto
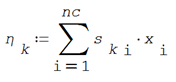
Finalmente, podemos evaluar los logaritmos naturales del coeficiente de actividad residual y el de actividad en mezcla para cada componente.
El logaritmo natural del coeficiente de actividad residual de cada componente es
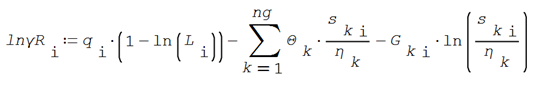
Y el logaritmo natural del coeficiente de actividad combinatorio de cada componente es, a su vez
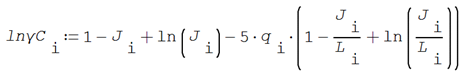
Finalmente, el Coeficiente de Actividad en mezcla se evalúa con la expresión
![]()
Un criterio para medir la no idealidad de la mezcla en solución podría ser evaluar que tanto se aleja de la unidad la sumatoria
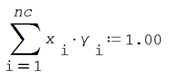
Se ilustra el procedimiento en el siguiente ejemplo.
Ilustración.
Evaluar los coeficientes de actividad para una mezcla a 334.85 K de n-hexano
(1) / etanol (2) / metilciclopentano (3) y benceno
(4) a las siguientes composiciones molares x1 = 0.162, x2
= 0.068, x3 = 0.656 y x4 = 0.114.
Aplicando todas las fórmulas de los parámetros en
mezcla se obtienen los coeficientes de actividades del sistema
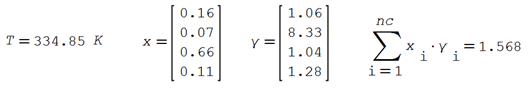
En al anexo 06 se incluye la codificación en el Solver de SMathStudio de esta ilustración.
6.
Estimación
del ELV no ideal por UNIFAC y la ecuación de Raoult modificada
Para estimar los puntos de equilibrio en mezclas multicomponentes se puede utilizar la ecuación de Raoult para las dos fases ideales
![]()
Para estimar esos puntos en sistemas no ideales se puede hacer una aproximación, utilizando la ecuación de Raoult modificada que introduce la no idealidad en la fase de la solución, considerando la fase gaseosa ideal
![]()
en donde ϒi es el coeficiente de actividad de la especie i en mezcla.
Otra posibilidad sería incorporarle a la ecuación de Raoult el coeficiente de fugacidad de las especies en la fase vapor, sin embargo, la mayor no idealidad se presente en la fase condensada, por lo cual esta ecuación es poco útil.
Sin embargo, considerar la no idealidad en ambas fases provee la posibilidad de estimar valores para los puntos de equilibrio con muy buen ajuste con los datos experimentales.
La ecuación de Raoult no ideal incorpora el coeficiente PHI de fugacidad par la fase vapor, resultando
![]()
en donde ψi es el coeficiente de fugacidad de la especie i en la fase vapor.
Se incluye una ilustración que muestra el procedimiento para evaluar el equilibrio líquido vapor en un sistema binario, aplicando las diversas opciones de cálculo, considerando o no idealidad de fase.
Ilustración. Se tiene el sistema etanol (1) / benceno (2) a 45§C, conteniendo el 51.99% molar de etanol. Determinar el ELV para diferentes casos de no idealidad. Se conocen los coeficientes de actividad de los componentes a la temperatura del sistema ϒ1 = 1.3987 y ϒ2 = 1.7065.
Datos disponibles.
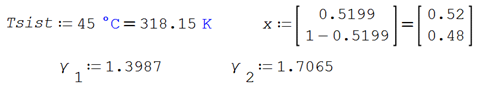
Constantes de Antoine
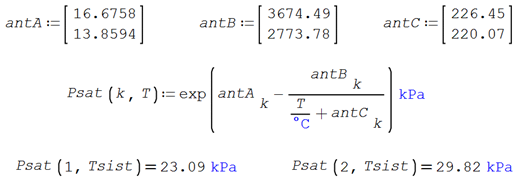
Propiedades críticas

Evaluación de los coeficientes viriales utilizando fórmulas de mezclado tal como se muestra el procedimiento en la sección 2.3

Para establecer las composiciones de ELV utilizando la ecuación de Raoult Ideal

Para establecer las composiciones de ELV utilizando la ecuación de Raoult Modificada en la fase líquida

Puede comprobarse que al asumir no idealidad en la fase líquida se introduce una fuerte corrección a los valores calculados en idealidad.
Para establecer las condiciones de ELV utilizando la ecuación de Raoult Modificada en la fase líquida y agregando los coeficientes de fugacidad para la fase vapor
Las fórmulas de los coeficientes de fugacidad en mezcla desarrolladas en la sección 2.4, para un sistema binario se simplifican a
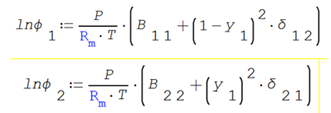
Debido a que los coeficientes de fugacidad en mezcla son función de la presión, se deberá desarrollar un proceso iterativo para resolver las condiciones de equilibrio líquido vapor.
El resultado obtenido es el siguiente y el procedimiento de cálculo se muestra en el anexo 7

Si en vez de los coeficientes de fugacidad en mezcla se utilizan los coeficientes de fugacidad en saturación (PHI) también desarrolladas en la sección 2.4, se simplifican para una mezcla binaria
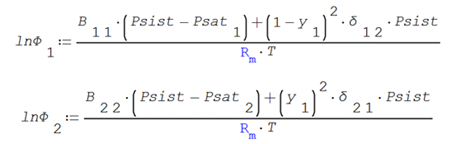
El resultado obtenido es el siguiente y el procedimiento de cálculo también se muestra en el anexo 7

Los valores experimentales son
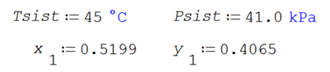
Es importante notar que los resultados obtenidos introduciendo los coeficientes de fugacidad o los coeficientes PHI, introducen muy poca variación en los resultados que si se la aplicación de la ecuación de Raoult modificada que prescinde de estos coeficientes.
En tal sentido, en la mayoría de los casos se puede asumir idealidad en la fase vapor sin introducir mucha variación en los resultados y evitar realizar los cálculos iterativos que complican la resolución del problema.
En una mezcla que contenga vapores y solución líquida coexistiendo en equilibrio, la temperatura y presión son uniformes en todo el recipiente que los contenga. Por ello pueden medirse esas propiedades de estado con instrumentos apropiados, y determinar las composiciones por medio de muestras que proporcionen los valores de las fracciones molares tanto en el vapor (yi) como en el líquido (xi).
Por otra parte, en el aspecto teórico se define la fugacidad de las especies presentes en la fase vapor en equilibrio en términos del coeficiente PHI y la presión del sistema
![]()
Y para la fase condensada la expresión correspondiente de fugacidad, en términos del coeficiente de actividad y la presión de saturación de la especie en consideración es
![]()
En el equilibrio de fases se cumple la igualdad
![]()
De tal forma que se plantea la ecuación de equilibrio líquido vapor para sistemas no ideales
![]()
Si se asumen idealidad en el vapor, con buena aproximación al caso real como de demostró en la sección anterior, se obtiene la ecuación de Raoult modifica ya analizada en la sección anterior
![]()
Se presenta una ilustración que muestra el método para construir las gráficas de equilibrio liquido vapor no ideal evaluando los coeficientes de actividad en mezcla por el Método UNIFAC y utilizando la ecuación de Raoult modificada.
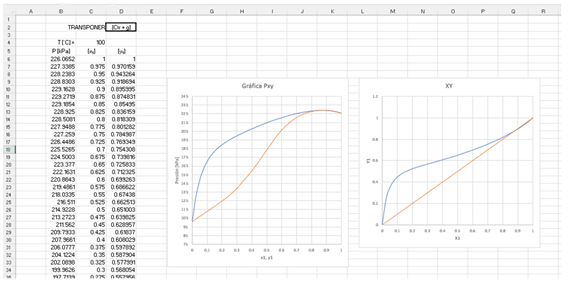
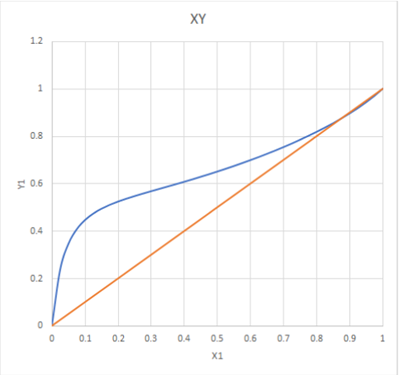
Ilustración. Se desea construir la gráfica PXY de equilibrio líquido vapor del sistema binario agua (1) / etanol (2) a 100§C
Datos. Se tienen los parámetros UNIFAC y las constantes de Antoine

Aplicando las fórmulas de reparto UNIFAC se evalúa el coeficiente de actividad residual para 41 puntos que servirán para la gráfica

y el coeficiente de actividad combinatorio
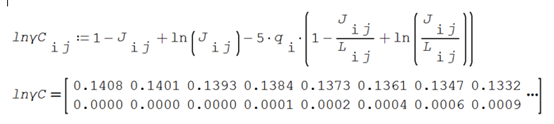
Finalmente, el valor del coeficiente de actividad

Se completan los cálculos evalúan las composiciones x-y

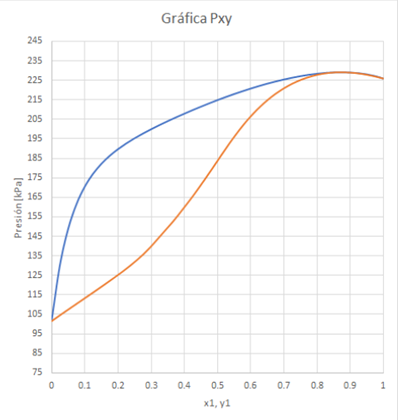
Y de aquí, las gráficas [P-x-y] y [x-y].
Tanto la gráfica de equilibrio Pxy
como la de XY muestran el punto azeotrópico para el sistema agua-etanol en
aproximadamente el 86% molar de etanol. Si esta gráfica se construye en base
másica mostraría el azeótropo en 95.63% de etanol en agua.
Se incluye en el anexo 08 la codificación de la
ilustración realizada con el Solver de SMathStudio.
●O'Connell, J.P. &
Haile, J. M. (2005). Thermodynamics:
fundamentals for applications. Cambridge University Press. New York.
●Polling, Bruce E.; Prausnitz, John M. & O'Connell, John P. (2000). The properties of Gases and Liquids. 5th
edition. McGraw Hill. New York.
●Salazar, Federico G. (2011). Constantes
de UNIFAC. Excel. https://fgsalazar.net/XLSM/UNIFAC.xlsm
●Sandller, Stanley I. (1999). Chemical and Engineering Thermodynamics. 3rd.
edition. John Wiley & Sons. New York.
●Smith, J.M; Van Ness, H.C.;
Abbott, M.M. & Swihart, M. T. (2022). Introduction to Chemical Engineering
Thermodynamics. 7th edition. McGraw Hill. Boston
Tabla No. 1. MODELO SIMéTRICO:
MEZCLAS BINARIAS
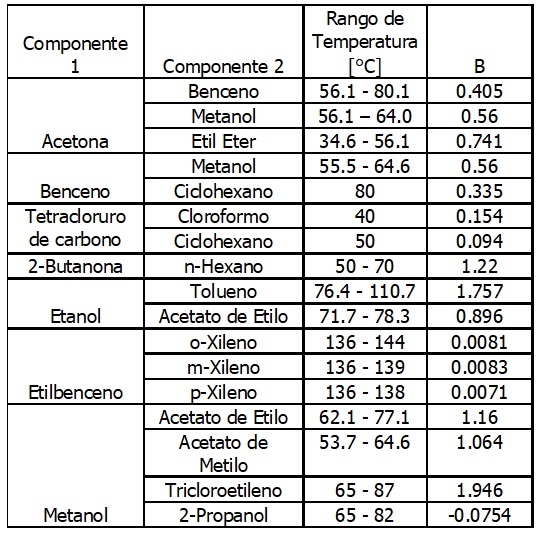
Fuente: SANDLER, STANLEY. (1989), O`CONNELL, J. &
HAILE, J.M. (2004)
Tabla No. 2. MODELO MARGULES: MEZCLAS BINARIAS
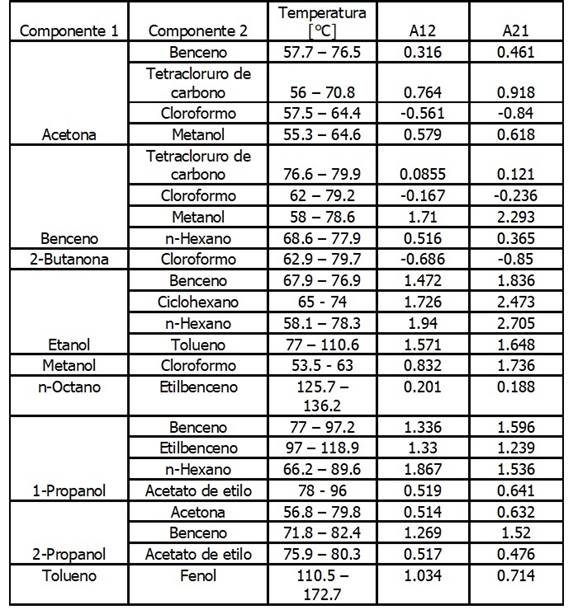
Fuente: O`Connell, John and J. Haille. (2004)
Tabla No. 3. MODELO DE VAN LAAR: MEZCLAS BINARIAS
Fuente: Sandler, Stanley (1989)
Tabla No. 4. ECUACIóN DE WILSON: MEZCLAS BINARIAS
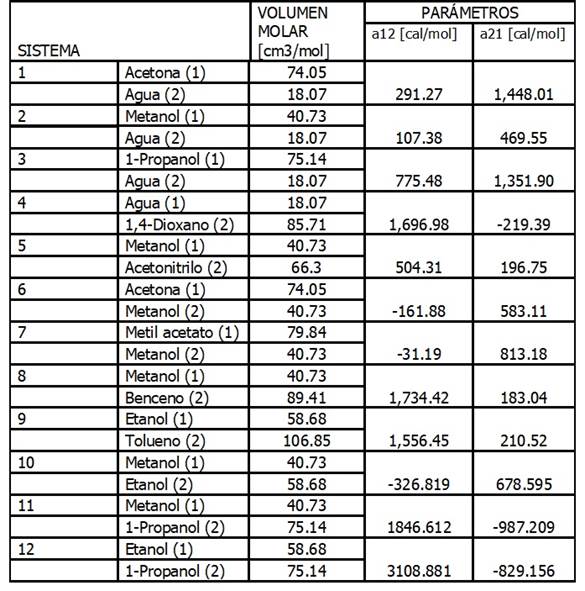
Fuente: Smith, J.M.; Van Ness,H.C. & Abbott,M.M. 2001
Tabla No. 5. ECUACIóN NRTL: MEZCLAS BINARIAS
Fuente: Smith, J.M.; Van Ness,H.C. & Abbott,M.M. (2001)
ANEXO 06. Codificación
en Solver SMathStudio para
la evaluación de los coeficientes de actividad en mezcla por el Modelo UNIFAC

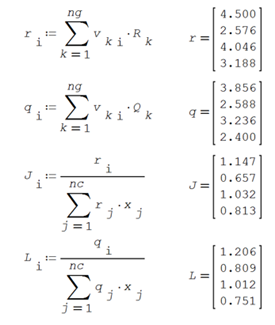
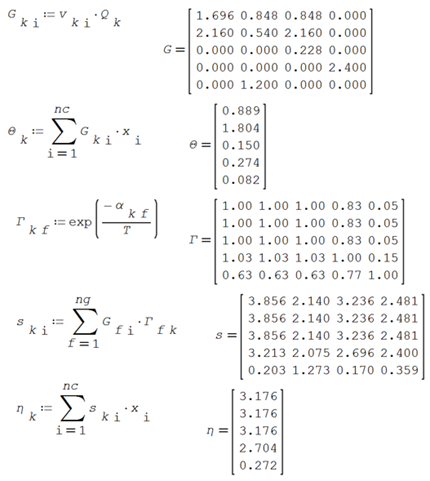
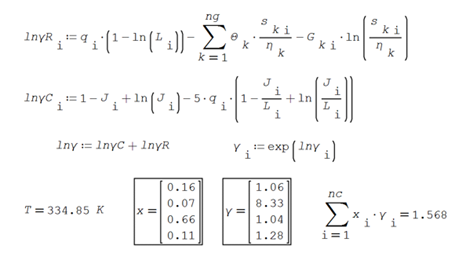
ANEXO 07. Codificación en Solver SMathStudio para la evaluación del ELV utilizando la
ecuación de Raoult modificada y los coeficientes de fugacidad en mezcla para un
sistema binario.


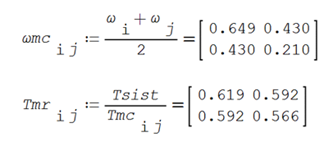


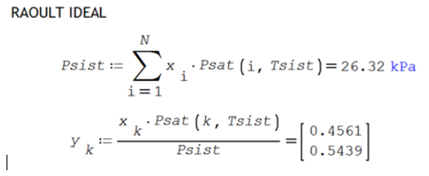

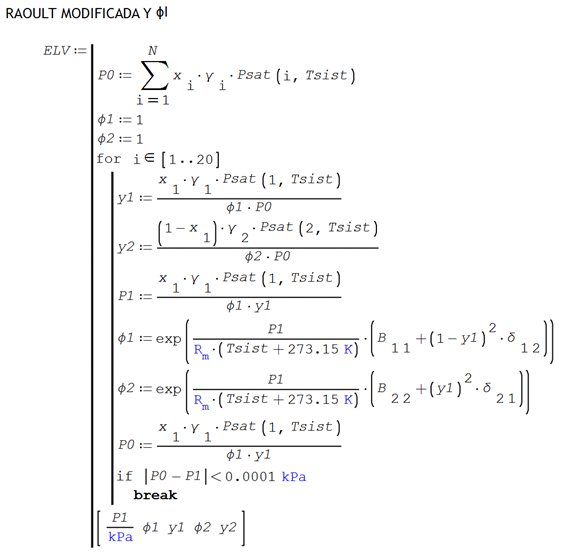
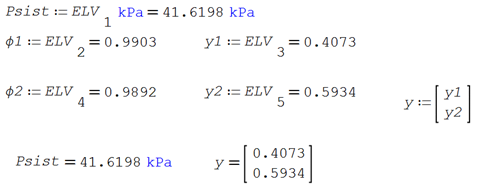


ANEXO 08. Codificación
en Solver SMathStudio para
la evaluación construcción de gráficas ELV utilizando la ecuación de Raoult
modificada y los coeficientes de fugacidad UNIFAC en mezcla para un sistema
binario


Se evalúan los parámetros de reparto de UNIFAC
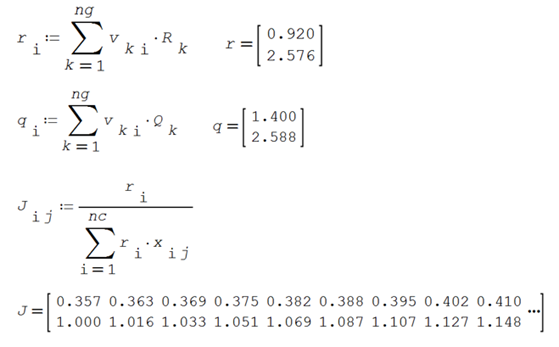

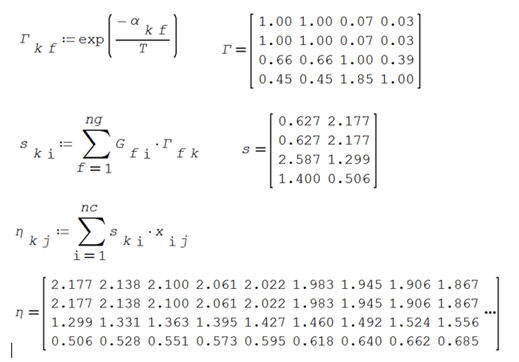
Se calculan
los coeficientes de actividad residuales y combinatorios y los coeficientes de
actividad UNIFAC, para un número determinado de puntos de la gráfica
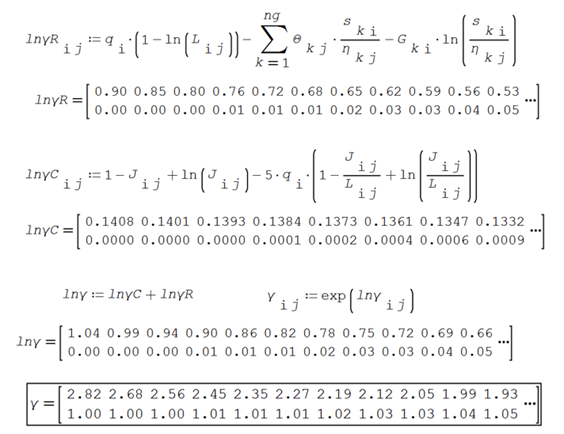
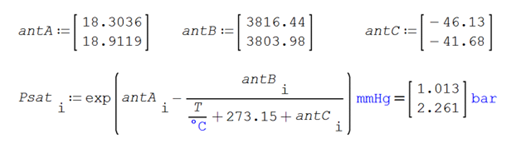
Se establecen los valores de x, y y la presión de equilibrio

Se realiza la interfase con una hoja Excel para
graficas los puntos obtenidos

Hoja Excel con las gráficas de equilibrio ELV no
ideal. El Excel tiene que estar en el mismo directorio del programa SMathSolver