CAPÍTULO III. SOLUCIONES QUÍMICAS
Contenido
1. Propiedades Parciales Molares
1.1. Sistemas binarios
2.1. Efectos caloríficos por mezclado
3. Evaporadores de Simple Efecto
4. Soluciones de Miscibilidad Parcial
4.1. Equilibrio de fases liquido - liquido
4.2. Equilibrio
en fases liquido - liquido - vapor
5. Referencias
ANEXOS
Anexo 1.
1. PROPIEDADES PARCIALES
MOLARES
Una
propiedad parcial molar (Θi) se
define como como la variación de esa propiedad con cambios en la concentración,
manteniendo constantes todas las demás propiedades del sistema
![]() (3.1)
(3.1)
De tal
forma que la propiedad total es función de las propiedades parciales molares y
se establece como
![]() (3.2)
(3.2)
Esta
propiedad parcial es una propiedad de mezcla real que se evalúa
experimentalmente. Se utiliza para estimar la propiedad total o absoluta de un
sistema no ideal. Se muestra en la tabla expresiones de las diferentes
propiedades parciales molares
Tabla 3.1. Propiedades parciales molares

(Sandler, 1999:330)
Considerando
un sistema de varias especies sin mezclar, el volumen y la entalpía totales son
la suma de los volúmenes y entalpías de las especies puras Vi y Hi
![]() (3.3a)
(3.3a)
![]() (3.3b)
(3.3b)
Sin
embargo, cuando esas especies se mezclan, ahora las propiedades totales serán
la suma de las propiedades parciales molares de cada especie en mezcla ![]()
![]() (3.4a)
(3.4a)
![]() (3.4b)
(3.4b)
Restando esas propiedades se obtiene el cambio de volumen y el calor por
mezclado.
El
cambio de volumen en el mezclado en términos de las propiedades parciales
molares y como sustancias puras es
![]() (3.5)
(3.5)
![]()
Es
decir, la variación en el volumen de mezclado es igual a la diferencia entre el
volumen parcial molar y el volumen como sustancia pura.
Por
otra parte, el calor de mezclado en términos de las propiedades parciales
molares queda definido como
![]() (3.6)
(3.6)
![]()
Otras
propiedades como la energía libre de Gibbs y la entropía pueden ser definidos
de igual forma.
Se ilustra
la definición de la capacidad calorífica a partir de las relaciones de Maxwell
![]()
donde H
es la entalpía de mezcla y ni indica que la derivada se toma sobre
un número constante de moles de todas las especies presentes.
La
capacidad calorífica parcial molar de cada especie i presente en la
mezcla se define como
![]()
donde nj son todas las demás especies diferentes de i.
Ahora, 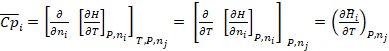
Entonces, ![]() para especies en mezcla y
para especies en mezcla y ![]() para especies puras.
para especies puras.
La
ecuación de Gibbs Duhem con las propiedades parciales
molares queda así
![]() (3.7)
(3.7)
Y para
el caso especial en que T y P sean constantes
![]() (3.8)
(3.8)
1.1. Propiedades
Parciales Molares en Soluciones Binarias
Para
una solución binaria la propiedad total de la mezcla evaluada en términos de
las propiedades parciales molares y las composiciones, a temperatura y presión
constantes, resulta así
![]() (3.9a)
(3.9a)
Y
aplicando el criterio de equilibrio de Gibbs Duhem
(3.8)
![]() (3.9b)
(3.9b)
Teniendo en cuenta que x1 + x2
= 1 y que dx1 = - dx2 se obtiene
![]() (3.9c)
(3.9c)
Eliminando x2 de la
ecuación (3.9a) tenemos
![]() (3.10)
(3.10)
Y combinando (3.9c) con (3.9d)
![]() (3.11)
(3.11)
Y alternativamente para x2
![]() (3.12)
(3.12)
Estas expresiones representan
líneas rectas tal como se muestra en la figura
Fig. 1. Propiedad total y
propiedades parciales molares
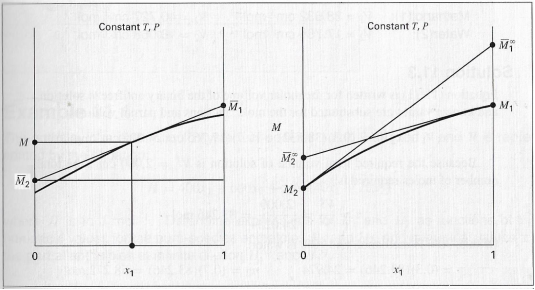
(Smith et al, 2022)
Si se
tiene, por ejemplo, la formulación de una solución al 50% en volumen de agua y
metanol, la teoría nos dice que el volumen total de la solución resultante será
la suma de los volúmenes de las sustancias puras, pero en la realidad no es
así. Al mezclar medio litro de agua con medio litro de alcohol se obtiene un
volumen menor al esperado de 1 litro solución al 50%v.
Refleja
el comportamiento no ideal de la mezcla y esta variación se origina en el
reacomodo espacial y eléctrico químico de las moléculas de cada especie
presente. Para el caso del agua y el alcohol, la presencia de enlaces débiles
tipo puente de hidrógeno del agua, favorecen la aproximación molecular interespecies originando esa disminución en el volumen
previsto.
Se
presenta una ilustración sobre la estimación de los volúmenes parciales molares
y el cálculo del volumen total real de la mezcla de resultante para el
intervalo de concentraciones entre especies puras, aplicando el procedimiento
sugerido por S. Sandler.
Ilustración. Para el sistema agua (1) / metanol (2) a 298.15 K
se dispone de información experimental del volumen de mezcla para diferentes concentraciones.
Se desea determinar los volúmenes parciales molares para una composición de 20%
de metanol.

Se
determinan los volúmenes de las sustancias puras

A
continuación, se calcula el volumen de solución ideal a partir de los volúmenes
de las sustancias puras y el volumen de la solución real utilizando los datos
experimentales. Con ambos valores se establece el cambio de volumen de mezcla

Se muestran los valores
obtenidos

Para poder hallar las
derivadas de ΔvMEZ es necesario determinar por
correlación matemática una ecuación de ajuste de datos
ΔvCALC(x) = fpolin(x)
Las ecuaciones para los
volúmenes parciales molares quedarían así utilizando las ecuaciones (3.10),
(3.11) y (3.12)
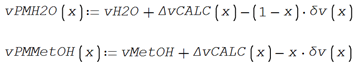
Y el volumen total calculado y
su derivada

Evaluando
los volúmenes parciales molares de ambas sustancias y el volumen total de
mezcla, comparado con el volumen ideal para la composición xH20 = 0.5 se
obtiene la siguiente gráfica
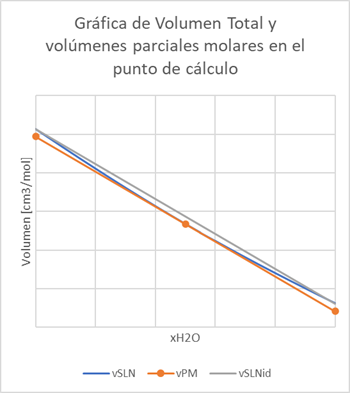
Analizando
la gráfica, vemos que los valores de la solución real corresponden a la línea
azul. Podemos comprobar que la curva de solución ideal corresponde a la línea
recta gris que corre entre los valores de los volúmenes de las sustancias
puras. Y el trazo naranja corresponde a
la línea que une las propiedades parciales molares de ambas sustancias a los
extremos de la gráfica con el punto de concentración analizado, en este caso x
= 0.50.
Se
incluye la codificación de este problema realizada en MathStudio
Solver en interfaz con Excel en el anexo 01.
La entalpia de mezcla puede ser evaluada a través de la definición de
las propiedades parciales molares de los componentes de la solución. Siendo la
solución no ideal, al mezclar los componentes se produce un calor de mezcla que
ocasiona una variación en el valor de la entalpia de la mezcla. Esta es la
entalpia en exceso de la mezcla no ideal.
Una solución ideal no produce calor de mezclado, de tal forma que su
entalpia en exceso por mezclado es igual a cero. Por otra parte, estos mismos
criterios aplican
para las demás propiedades de una solución no ideal incluyendo la
energía de Gibbs.
La
entalpía en exceso queda definida en términos del cambio de entalpía de
mezclado
![]() (3.13)
(3.13)
Y
consecuentemente las entalpías parciales molares en exceso de cada componente
se expresan en términos de la entalpía en exceso
![]() (3.14a)
(3.14a)
![]() (3.14b)
(3.14b)
Correspondiendo
las entalpías en exceso parciales molares a dilución infinita para cada componente
![]() y
y ![]() (3.15a) (3.15b)
(3.15a) (3.15b)
A
continuación, se presenta una Ilustración que utiliza el concepto de entalpía
en exceso, en base a las entalpías parciales molares, tal como lo presentan
Smith el al (2022).
Ilustración. Entalpia
de mezcla y Entalpia en Exceso de mezcla

En el anexo 02 se muestra
la codificación en SMathStudio en interfase con Excel
de esta gráfica.
2.1. Efectos
caloríficos por mezclado
![]()
 Las soluciones se
obtienen de mezclar en diversas proporciones sustancias afines que se diluyen
entre sí. Utilizando solutos miscibles en pequeñas cantidades en solventes
afines que se mezclan en cámaras de mezclado se pueden evaluar los efectos
caloríficos del proceso.
Las soluciones se
obtienen de mezclar en diversas proporciones sustancias afines que se diluyen
entre sí. Utilizando solutos miscibles en pequeñas cantidades en solventes
afines que se mezclan en cámaras de mezclado se pueden evaluar los efectos
caloríficos del proceso.
En la preparación de soluciones si estas fueran ideales no se tendría
ningún efecto calorífico. Sin embargo, al preparar una mezcla adicionando el
soluto, se inicia prácticamente en todos los casos, un efecto de liberación de
calor o de enfriamiento del recipiente que contiene la nueva solución. Este
efecto se debe a la búsqueda de un nuevo nivel de estabilidad de energía entre
las moléculas presentes en la solución. Recordemos que en muchos casos se da
una ionización entre las especies presentes librando la energía de enlace que
ya no se está utilizando.
Para evaluar el calor liberado (o absorbido)
durante la preparación de una mezcla, se suelen utilizar graficas que expresan
directamente el calor de mezcla contra la
cantidad
de moles de solvente utilizado por cada mol de soluto.
Estas son graficas especializadas que no
siempre están disponibles, sin embargo, son muy útiles. Ver fig. 3.1 por
ejemplo para soluciones de ácido sulfúrico en agua a diferentes concentraciones
y temperaturas.
Ilustración. Tres moles de agua y un mol de ácido
sulfúrico se mezclan isotérmicamente a 0°C. Se desea evaluar el calor
transferido para mantener la temperatura constante.
Con las masas moleculares y la composición se obtiene la
masa total de la mezcla
![]()
Y la composición es
![]() de ácido sulfúrico
de ácido sulfúrico
Leyendo en la fig. 3.1. para la composición y temperatura dada, la
entalpía de mezcla es aproximadamente ![]() de tal forma que para mantener la temperatura
constante hay que extraer un calor igual a
de tal forma que para mantener la temperatura
constante hay que extraer un calor igual a
![]()
Fig. 3. Diagrama
entalpía concentración para la solución ácido sulfúrico-agua a 100 kPa

(Sandler, 1999:326)
Otra opción
es utilizar graficas de entalpia de solución contra la composición del soluto,
a partir de las cuales se pueden determinar los efectos caloríficos originados
por la preparación de una mezcla a partir de dos soluciones originales (o de
las especies puras) en diferentes proporciones.
En
todo caso, para trabajar estas gráficas se establecen los puntos que
corresponden a las dos soluciones iniciales teniendo en cuenta la concentración
y la temperatura respectiva. Si se trata de sustancias puras se les localiza en
los ejes respectivos.
El
mezclado adiabático ocurre al no haber liberación de calor al mezclar, por lo
que la solución resultante aumenta su temperatura y entalpía, tal como se
muestra en la figura.
![]()
 Por otra parte, si el mezclado se realiza isotérmicamente, es decir,
extrayendo calor para mantener las condiciones iniciales, la localización de la
solución final quedará en la isoterma respectiva.
Por otra parte, si el mezclado se realiza isotérmicamente, es decir,
extrayendo calor para mantener las condiciones iniciales, la localización de la
solución final quedará en la isoterma respectiva.
El calor de mezclado se obtiene fácilmente,
restando los valores de las entalpías de solución para el caso adiabático y el
isotérmico, leídas en la gráfica
Qmezcla = ΔHadiabática – ΔHisotérmica
Se
presentan a continuación varias ilustraciones que muestras diferentes casos de
mezclas siempre leyendo la información en estas tablas de entalpía de mezcla y
concentración de una especie.
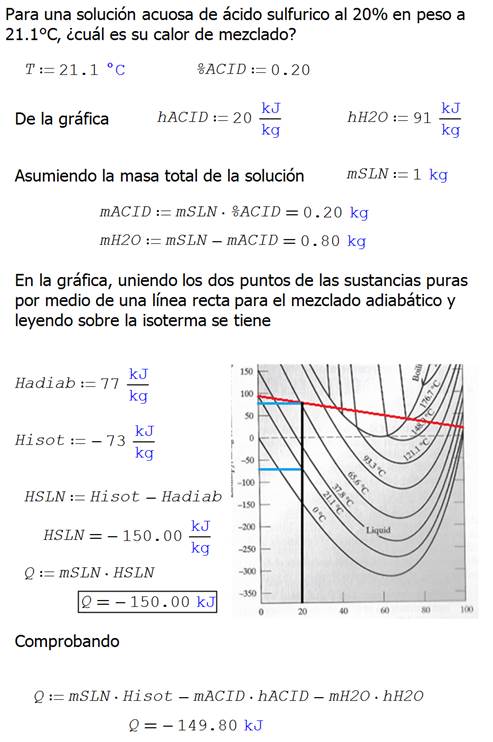
Ilustración.
Para una solución acuosa de ácido sulfúrico al 20% en peso a 26.7°C, ¿cuál es
su calor de mezclado?
Solución.
Para formar una solución al 20% se necesita disolver el ácido concentrado al
100% en agua pura. Asumimos que ambas sustancias están inicialmente a 21.1°C.

Asumiendo
la masa total de la solución mSLN = 1.0 kg

En la gráfica, uniendo los dos puntos de las
sustancias puras por medio de una línea recta para el mezclado adiabático y
leyendo sobre la isoterma se tiene

|
Haciendo una comprobación en términos de los compuestos
puros
|
|
Se
incluye en el Anexo 02 la codificación en SMath Studio solver.
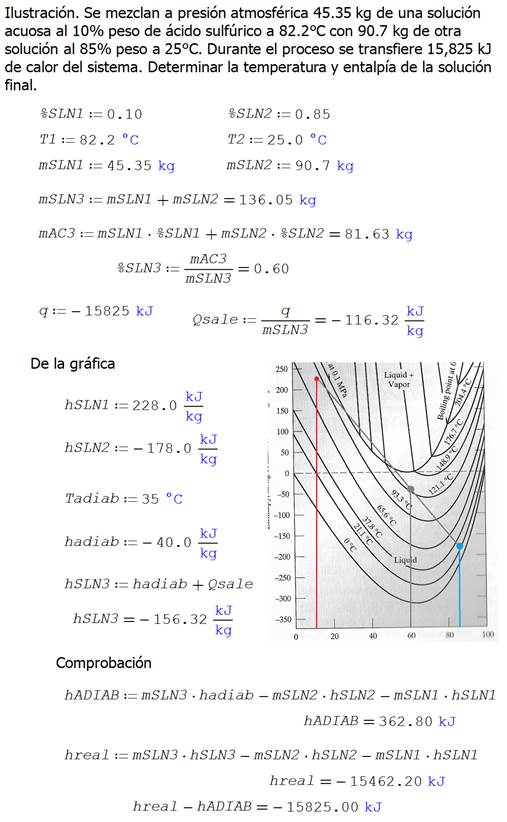
Ilustración.
Se mezclan a presión atmosférica 45.35 kg de una solución acuosa al 10% peso de
ácido sulfúrico a 82.2°C con 90.7 kg de otra solución al 85% peso a 25°C.
Durante el proceso se transfiere 15,825 kJ de calor del sistema. Determinar la temperatura
de la solución final.
Solución.
Datos proporcionados

Calculando
la composición de la solución final

Determinando
el calor específico liberado
![]()
Se
procede a localizar los puntos en la gráfica y leer la información.
|
De la gráfica
Finalmente, la entalpía específica de la solución
resultante es
|
|
A manera de comprobación

Que corresponde
al valor del calor extraído.
Se
incluye en el Anexo 03 la codificación en SMath Studio solver.
2.2. Tablas de Calor de Disolución
Tal
como hemos podido apreciar en las ilustraciones anteriores, para evaluar
efectos caloríficos en la preparación de mezclas se puede utilizar gráficas,
pero también existe información tabulada. Generalmente esta información se
presenta así:
En la tabla, la información se interpreta de
la siguiente forma, por ejemplo
Ca + Cl2 + n H2O = CaCl2 (n H2O)
indica
que estamos formando una solución de un mol de cloruro de calcio en n moles de agua, y se incluye el calor de formación.
Por
ejemplo
Ca + Cl2 + 50 H2O = CaCl2 (50 H2O) Hf5 = -872.91 kJ
indica que 1
mol de cloruro está disuelto en 50 moles de agua. Es decir, 1/51= 1.961% mol de
CaCl2 en solución
liberan un calor equivalente a -872.91 kJ.
Tabla 1. Calores de mezclado

(Smith et al, 2022)
Utilizando
el principio conceptual de la regla de Hess para determinar entalpias de
reacción a partir de datos de formación de las sustancias, para el caso de soluciones
se asume que el agua constituye en sí una especie elemental, de esta forma
|
CaCl2 = Ca + Cl2 (S) Ca + Cl2 (S) + nH2O = CaCl2 (nH2O) _________________________________________ CaCl2 + nH2O = CaCl2 (nH2O) |
Hf x (-1) =
795.8 kJ Hfn _____________________________ ΔHsln = Hfn - 795.8 kJ |
|
Con la información del cuadro anterior se puede
graficar el calor liberado por la solución para diferentes moles (n) de
solvente agregado. Por ejemplo, n = 20 moles de agua, el calor de solución
en términos del calor de formación (de la tabla) corresponde a ΔHsln = -(-870.06
kJ) – 795.8 kJ = 74.26
kJ |
Fig. 5. Calor liberado
por mezcla
|
Ilustración.
Se desea preparar un mol de una solución 3.846% molar de cloruro de calcio en
agua a 25°C. Determinar el efecto calorífico.
Solución.
Para conocer la cantidad de moles de agua que contiene esa mezcla por cada mol
de cloruro
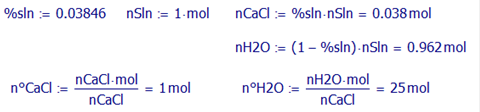
La
mezcla de 3.846% contiene 25 moles de agua por mol de sal
Ya
podemos ir a la Fig. 5 a leer para esas condiciones, que el calor liberado
corresponde a -75.5 kJ por cada 25 moles de agua que se adicionen.
Como solamente deseamos un mol de solución el
calor respectivo será

3.
Evaporadores de Simple Efecto
Atendiendo
el procedimiento utilizado para calcular el calor de mezclado en soluciones no
ideales, se puede utilizar ese mismo principio para resolver problemas de
Evaporadores de simple efecto.
 En primer lugar, recordemos que
un evaporador es un sistema que recibe una solución de la cual, en principio,
solamente el solvente es volátil, y el/los solutos son sustancias solubles en
el solvente, pero no volátiles. De esa cuenta tenemos soluciones diversas de
sales en agua, de azucares en agua, y así infinidad de ejemplos, en donde para
concentrar y separar esos solutos se efectúa un calentamiento provocando la
evaporación del solvente hasta conseguir la concentración final deseada.
En primer lugar, recordemos que
un evaporador es un sistema que recibe una solución de la cual, en principio,
solamente el solvente es volátil, y el/los solutos son sustancias solubles en
el solvente, pero no volátiles. De esa cuenta tenemos soluciones diversas de
sales en agua, de azucares en agua, y así infinidad de ejemplos, en donde para
concentrar y separar esos solutos se efectúa un calentamiento provocando la
evaporación del solvente hasta conseguir la concentración final deseada.
 Su funcionamiento se muestra en el siguiente esquema. Comparando este
equipo con una cámara de mezclado utilizada en la sección anterior para
preparar soluciones, vemos que su funcionamiento como sistema es exactamente
inverso al del evaporador.
Su funcionamiento se muestra en el siguiente esquema. Comparando este
equipo con una cámara de mezclado utilizada en la sección anterior para
preparar soluciones, vemos que su funcionamiento como sistema es exactamente
inverso al del evaporador.
Tomando
en cuenta este hecho, se pueden resolver problemas de evaporadores de simple
efecto utilizando graficas de entalpia de solución o de calor de mezcla,
descritas previo.
Ilustración. Calor de mezcla por evaporación en una etapa
Se
tiene una cámara de mezclado con 1.70 kg de agua a 25ºC que reciben 0.30 kg de
sal de LiCl también a 25ºC. Si el mezclado se efectúa
a temperatura constante, evaluar el efecto calorífico en este sistema.
Solución.
Para establecer las propiedades de los compuestos iniciales y solución
resultante podemos consultar la siguiente figura
Fig. 8. Calores de solución
a 25°C para dos compuestos clorados

Gráfica 12.14, Smith et al (2005)
Esta
gráfica es similar a la gráfica calculada (Fig. 5), ya que no se refiere a la
entalpía de la solución vs diferentes composiciones de mezcla, sino al Calor
Liberado al mezclar un determinado número de moles de solvente por cada mol de
soluto. En este caso se refiere a moles de agua por cada mol de LiCl.
Entonces,
lo primero que tenemos que hacer es calcular los moles utilizados en este
proceso:
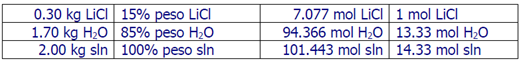
 De la gráfica leemos que 13.33 moles de agua a 25ºC al disolver un mol
de LiCl a 25ºC liberan -33.8kJ/mol de calor.
De la gráfica leemos que 13.33 moles de agua a 25ºC al disolver un mol
de LiCl a 25ºC liberan -33.8kJ/mol de calor.
La
solución resultante a 25ºC corresponde a 2 kg de mezcla al 15% peso de LiCl que libera -239.25 kJ de calor para mantenerse
isotérmica.
Ilustración.
Calor de evaporación
Se
tiene un evaporador de simple efecto que contiene 2.00 kg de una solución al
15% de LiCl en H2O a 25ºC. Si se deseara separar
completamente ambas sustancias, calcular el calor requerido, asumiendo que el
proceso se pudiera llevar a 25ºC por efecto de una operación a una presión de
vacío determinada.
Solución.
 Como podemos ver, las condiciones de este proceso son exactamente las de
la ilustración anterior solo que en sentido puesto. En vez de mezclar deseamos separar.
Como podemos ver, las condiciones de este proceso son exactamente las de
la ilustración anterior solo que en sentido puesto. En vez de mezclar deseamos separar.
Dado
que ya sabemos la cantidad de calor que se liberaría por la mezcla isotérmica,
esta cantidad corresponde al calor requerido para separar ambas sustancias, solamente
que con signo opuesto.
Es
decir, la cantidad de calor requerida por un evaporador de simple efecto
operando a 25ºC sería de +239.25 kJ
Consiste
este procedimiento en un método de cálculo indirecto, haciendo la suposición de
que se puede efectuar la evaporación en forma exactamente inversa al proceso de
mezclado. Posiblemente en la práctica esto no sea totalmente cierto
pero como método de cálculo es válido.
Ejercicio.
Se sugiere revisar el Ejemplo 12.5 del texto de Smith et al (2005) en donde se
utiliza este procedimiento.
5. Referencias Bibliográficas
·
Sandller, Stanley I. (1999). Chemical and
Engineering Thermodynamics. 3rd. edition. John Wiley & Sons. New
York.
·
Smith, J.M; Van Ness, H.C.; Abbott, M.M. & Swihart, M. T. (2022). “Introduction to Chemical Engineering
Thermodynamics”. 7th edition. McGraw Hill. Boston
·
O’Connell, J.P. & Haile, J. M. (2005). Thermodynamics: fundamentals for
applications. Cambridge University Press. New York.
·
Polling, Bruce E.; Prausnitz, John M. &
O’Connell, John P. (2000). The properties of Gases and Liquids. 5th edition. McGraw Hill. New York.
ANEXO 2. Codificación en SMath
Studio solver la codificación de los problemas de
calor de mezcla
ANEXO 3.
Codificación en SMath Studio Solver
la codificación de los problemas de calor de mezcla
ANEXO 4. Codificación en SMath
Studio solver la codificación de los problemas de
calor de mezcla