TERMODINÁMICA DEL EQUILIBRIO
CAPíTULO IV. EQUILIBRIO DE REACCIÓN QUÍMICA
Contenido
1. Conversión y
Coordenada de Reacción
1.1.
Avance
de Reacción
1.2.
Fracción
de reacción
2.
Ecuaciones
Independientes y Regla de las Fases
2.1.
Reacciones
Independientes
2.2.
Grados
de Libertad
3.1.
Caso 1. Combustible puro en cantidades estequiométricas con
oxígeno
3.2.
Caso 2. Combustible puro y aire seco en exceso
3.3.
Caso 3. Combustible puro precalentado y aire en exceso con
humedad
4.
Criterios de Equilibrio en Reacción Química
4.1.
Energía de Gibbs y Constante de Equilibrio
4.2.
Evaluación de la Constante de Equilibrio: Efecto de la temperatura,
presión y composición
4.3.
Sistemas de Reacciones Múltiples
ANEXOS
ANEXO 01. Ilustración 4.1
codificación en SMathSolver con la interfase a Excel
ANEXO 02. Ilustración 4.2
codificación en SMathSolver
ANEXO 03. Ilustración 4.3. codificación
en SMathSolver
ANEXO 04. Ilustración 4.8, 4.9 y 4.10. codificación
en SMathSolver
1. Conversión y Coordenada de Reacción
El avance o extensión de la reacción, simbolizada con la
letra ξ, cuantifica la variación de la cantidad de especies químicas
que intervienen en una reacción y tiene unidad de mol. Fue introducido por el científico belga Theophile de Donder.
Se define en términos de las cantidades iniciales y finales de los
componentes y sus coeficientes estequiométricos
ε = (ni - n
teniendo
presente los signos de los coeficientes de productos y reactivos. Es decir, νi < 0 para los reactivos y νi > 0 para los productos.
Para evaluar la composición final de reactivos y productos en
función del avance de reacción
ni = n
También se
determinan los moles totales de reacción en base al avance
![]() (4.3)
(4.3)
en donde
![]()
![]()
De tal
forma que las fracciones molares pueden expresarse como
![]() (4.4)
(4.4)
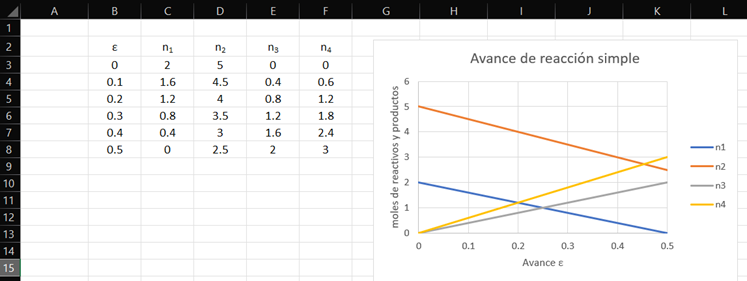
Ilustración 4.1. Fracciones molares y coordenada. Desarrolle las expresiones que definen la
coordenada de reacción para el siguiente caso en donde 2 moles de amoniaco
reaccionan en fase gaseosa con 5 moles de oxígeno
![]()
Las fórmulas desarrolladas para cada especie en esta reacción
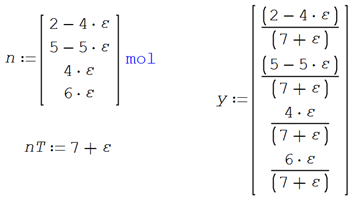
Y utilizando la fórmula de recurrencia
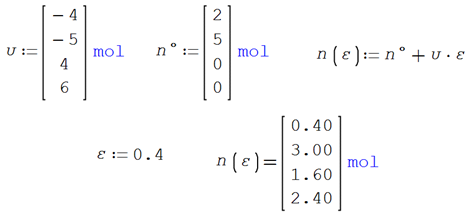
Obteniéndose la gráfica correspondiente
Se incluye en al anexo 01 la codificación en SMathSolver de esta
ilustración.
Ilustración 4.2. Coordenadas de reacción para un sistema de
reacciones
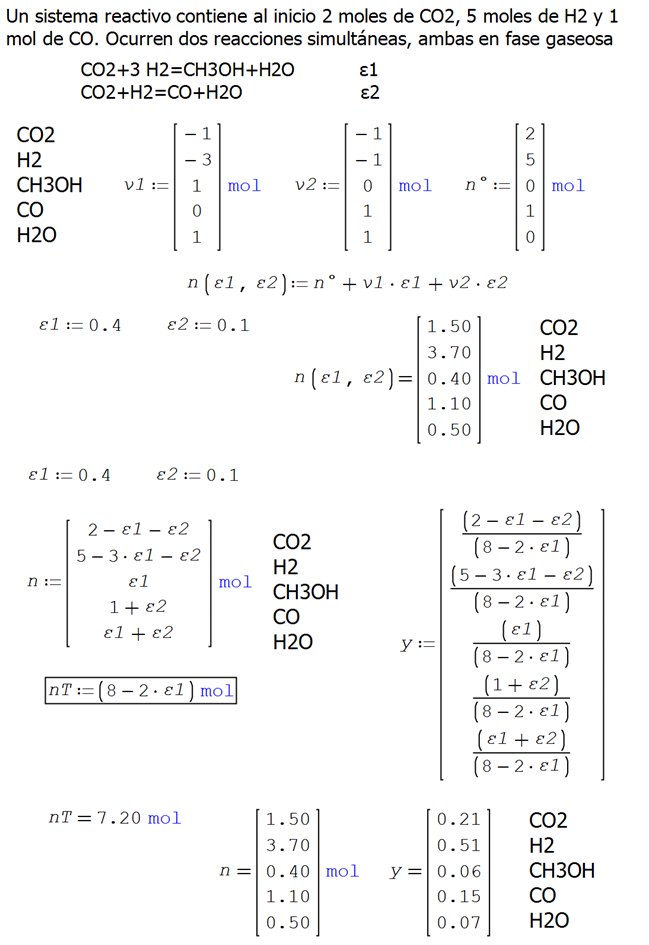
Un sistema reactivo contiene al inicio 2 moles de CO2, 5 moles de
H2 y 1 mol de CO. Ocurren dos reacciones simultáneas, ambas en fase gaseosa
![]() ε1
ε1
![]() ε2
ε2
Se tiene la estequiometría y las condiciones iniciales del sistema
reactivo

Las fórmulas desarrolladas para los moles y composición final de cada
especie en ambas reacciones
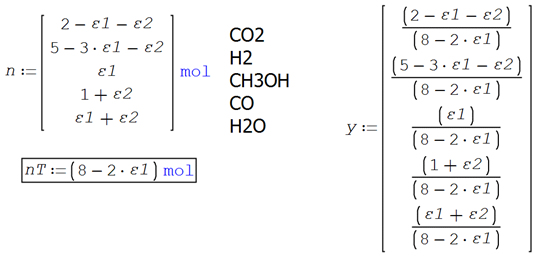
Y utilizando las fórmulas de recurrencia
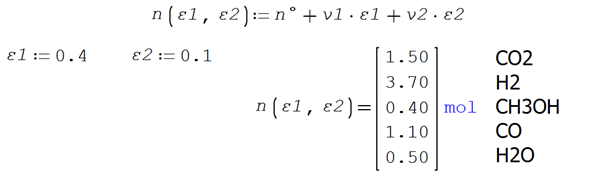
Se incluye en el anexo 02 la codificación en SMathSolver de esta
ilustración.
Es la fracción de un reactivo en una reacción que se convierte en
otra sustancia y se simboliza como XA. Generalmente se toma el
reactivo limitante de referencia y se define como
![]() (4.5)
(4.5)
siendo A el
reactivo limitante o de referencia, de tal forma que
![]() (4.6)
(4.6)
Y para los demás componentes en la reacción
![]() (4.7)
(4.7)
Además, tenemos que
![]() (4.8)
(4.8)
Y finalmente
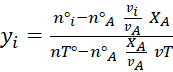 (4.9)
(4.9)
Ilustración 4.3. Coordenada
y avance de reacción en reacción simple
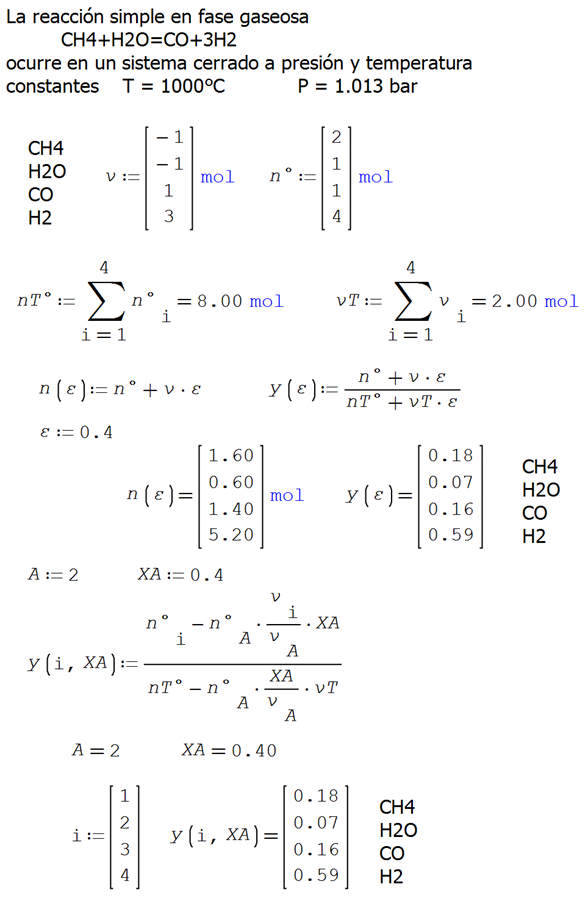
La reacción simple en
fase gaseosa
![]()
ocurre en un sistema cerrado a presión y
temperatura constantes
T = 1000°C P = 1.013 bar
Las cantidades de cada especie presente son 2
moles de CH4, 1 mol de H2O, 1 mol de CO y 4 moles de H2.
La estequiometría y las condiciones iniciales de la reacción
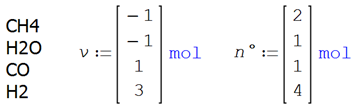
Se establecen los moles totales iniciales y el coeficiente global
de reacción

Las fórmulas desarrolladas para los moles y composición final de
cada especie en la reacción en función del avance de reacción ε
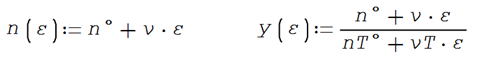
Por ejemplo
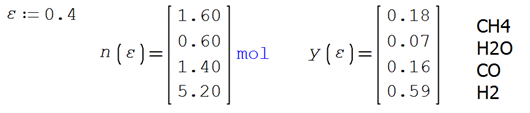
Aplicando ahora la definición de la fracción de conversión
XA y seleccionando el agua como reactivo limitante, se tienen la
siguiente expresión
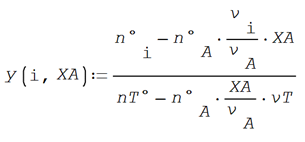
Para este ejemplo el rectivo limitnte es el agua, A = 2 y XA = 0.40
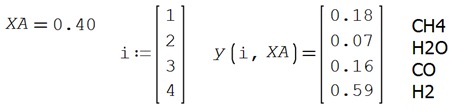
Comparando con el resultado de la primera parte, se puede
comprobar que corresponde a la misma respuesta obtenida con el avance de
reacción.
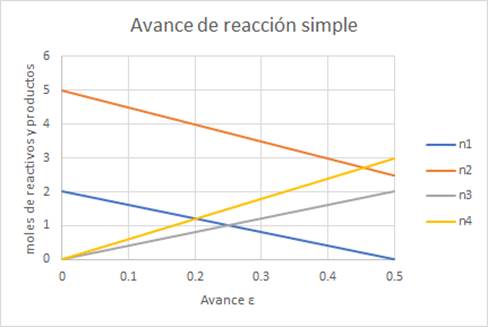
Se puede obtener la gráfica correspondiente utilizando indistintamente
el avance o la coordenada de reacción, dependiendo del tipo de datos que se
tengan.
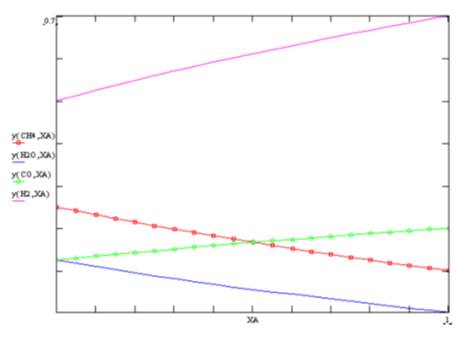
Se incluye en al anexo 03 la codificación en SMathSolver de esta
ilustración.
2. Reacciones
Independientes y Regla de las Fases
2.1. Reacciones
Independientes
Se refiere al número mínimo de reacciones posibles entre las
especies presentes en un sistema reactivo. Ello obliga a que ninguna de las
reacciones del conjunto resulte de una combinación lineal de las demás.
Para establecer el número de reacciones
independientes se utiliza el Procedimiento de Denbigh,
en el cual:
1. Se escriben todas las ecuaciones estequiométricas de formación de todas las especies
moleculares presentes, a partir de sus constituyentes atómicos.
2. Se selecciona una de las ecuaciones obtenidas, que contenga especies químicas que no están realmente
presentes en el sistema de reacción.
3. Sustrayendo y adicionando apropiadamente esa ecuación seleccionada del resto de ecuaciones
planteadas, se elimina esa especie química no presente.
4. Como resultado del paso anterior, se elimina una de las
ecuaciones estequiométricas planteadas al inicio.
5. Se repite el procedimiento hasta que sean eliminadas todas las especies atómicas no
presentes en el sistema reactivo.
6. Las ecuaciones que finalmente quedan, constituyen el conjunto de ecuaciones independientes del
sistema reactivo analizado.
Se incluye una Ilustración
del procedimiento
Ilustración 2.1. Para un sistema gaseoso consistente en CO, CO2,
H2, H2O y CH4, en equilibrio de reacción química, se desea determinar el número
de reacciones independientes.
Solución:
1.
Se plantean las ecuaciones
estequiométricas a partir de las especies atómicas:
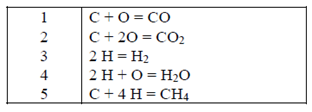
2.
Se escoge la ecuación 3
y se elimina H como especie no presente en el sistema
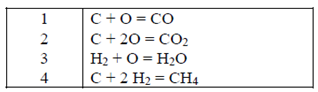
3.
Ahora se escoge la
ecuación 1 y se elimina C como especie no presente en el sistema
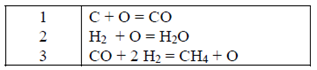
4.
Finalmente, se escoge la
nueva ecuación 2 y se elimina O como especie no presente en el sistema
![]()
Por lo tanto, el número de reacciones
independientes es r = 2
2.2. Grados de Libertad
El estado intensivo de un sistema PVT se establece fijando la
temperatura, presión y las composiciones de todas las fases. Sin embargo, para
estados de equilibrio esas variables no son todas independientes, y fijando un número
limitado de ellas, automáticamente se establecen las otras.
El número de variables independientes, que pueden ser
arbitrariamente especificadas y que deben ser establecidas para fijar el estado
intensivo de un sistema en equilibrio, se le llama el Número de Grados de
Libertad del Sistema, y se determina por la regla de las fases
F = 2 + N - (p + r + s) (4.10)
en donde N el número de especies químicas presentes
p es el número de fases
r el número de reacciones independientes
s es un factor para casos especiales.
Ilustración 2.2. Para el sistema reactivo planteado anteriormente
de CO, CO2, H2, H2O y CH4 (como mezcla
de gases en equilibrio de reacción), se desea determinar el número de Grados de
libertad de ese sistema
Solución:
El número de especies químicas presentes N = 5
El número de fases existentes p = 1
El número de reacciones independientes r = 2
No existen
consideraciones especiales s = 0
Para determinar el número de reacciones independientes ver la sección.
Por lo tanto,
F = 2 + 5 - (1 + 2 + 0) = 4
Este resultado indica que, por ejemplo, al ser especificado P y T
del sistema, se establecen 2 reacciones molares en la mezcla en equilibrio de las
5 especies presentes, sin necesidad de especificar nada más.
Todos los procesos reactivos involucran un cambio en las
estructuras atómico-molecular de las especies presentes con un efecto calorífico
a los alrededores, dependiendo si se trata de reacciones exotérmicas o
endotérmicas.
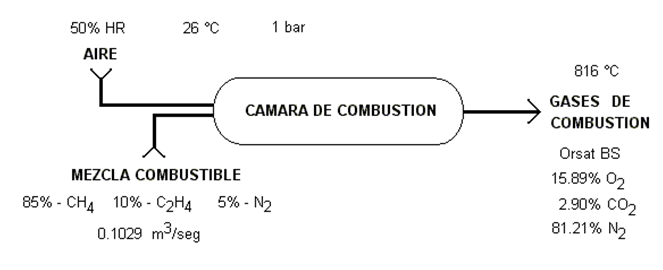
Es conveniente recordar sobre los tipos de combustión existentes.
La reacción de combustión teórica aplicada a cualquier alcano que implica la
combustión total con oxígeno puro, para producir dióxido de carbono y vapor de
agua
![]() (4.11)
(4.11)
En este caso, se definen los coeficientes de reacción en términos
de las relaciones molares resultantes del balanceo estequiométrico por cada mol
de combustible reaccionando. Por ejemplo,
![]()
![]()
Y la reacción de combustión incompleta en la cual se produce
monóxido de carbono resultado de ineficiencias tales como temperaturas muy
bajas o contaminantes en el proceso, como la humedad del aire.
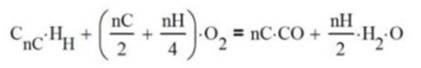 (4.12)
(4.12)
Por ejemplo,
![]()
![]()
Reuniendo ambos casos se tiene la reacción de combustión
incompleta integrada para hidrocarburos simples
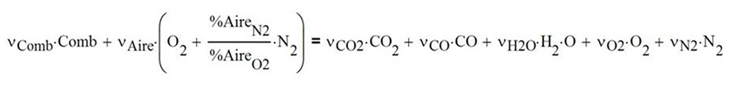
En donde los coeficientes estequiométricos quedan definidos así
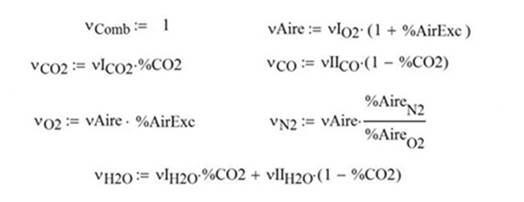
El aire teórico es la
cantidad estequiométrica que se requiere para lograr combustión completa. Y el aire
en exceso es aquel que se agrega sobre la cantidad estequiométrica,
generalmente para garantizar una mayor eficiencia de operación
%aire teórico = 100%aire estequiométrico + %exceso (4.13)
Por ejemplo, el 50% de aire en exceso equivale al 150% del aire
teórico y el 200% en exceso equivale al 300% de aire teórico.
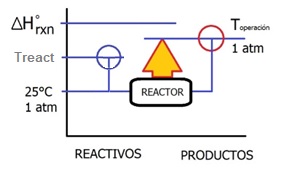
Existen tres tipos de operación de quemadores y cámaras de
combustión, siendo el primero y segundo casos consideraciones termodinámicas
límites y el tercero la operación industrial, intermedia entre las dos
posibilidades anteriores.
»
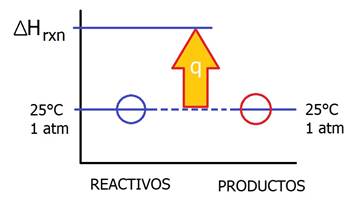
Extracción
máxima de calor (calor estándar de reacción) considera la operación en la cual la temperatura de los gases de salida es la misma que la de los reactivos, lo cual implica la extracción de calor máxima teórica.
|
|
|
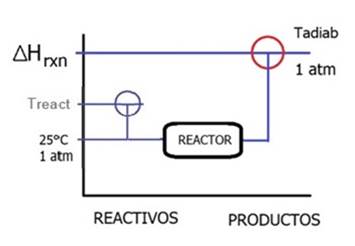
» Proceso de operación adiabática en donde la temperatura de los gases de salida es máxima ya que no hay extracción de calor.
|
|
|
» Extracción parcial de calor en donde la temperatura de los gases de salida es mayor a la temperatura de los reactivos, pero inferior a la temperatura de flama adiabática.
|
|
|
En el planteamiento de este tipo de problemas se busca resolver cualquiera de las tres incógnitas:
a.
Determinar la temperatura máxima de combustión que se alcanza cuando el reactor opera adiabáticamente. Se le conoce como Temperatura de Llama Adiabática.
b.
Determinar el calor necesario de extraer del reactor para obtener productos a una temperatura determinada
c.
Determinar la temperatura de los productos (gases de combustión) cuando se extrae una cantidad de calor determinada.
Pueden darse cualquiera de esas tres posibilidades.
Caso 1. La situación más sencilla: se alimenta un combustible puro en cantidades estequiométricas con oxígeno y se hacen reaccionar.
Son sistemas reactivos muy eficientes, que industrialmente representan un costo mayor de operación al utilizar oxigeno puro en vez de aire, pero puede ser requerido en algunos procesos especiales o donde se necesite generar suficiente calor. Se ilustra el procedimiento
Ilustración 4.4. Se utiliza un horno de combustión que opera a 1 atm, para quemar 10 mol/h de octano puro precalentado a 35°C con oxígeno puro a 25°C en cantidades estequiométricas, asumiendo combustión completa. Evaluar:
a) La temperatura de llama adiabática
b) El calor extraído cuando la temperatura de los gases de combustión es 250°C
c) La temperatura de salida de los gases de chimeneacuando se extraen 3,500 kJ/hr de calor
Solución.

Los coeficientes de la reacción de combustión teórica ideal son
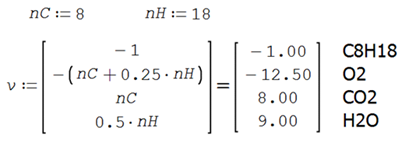
De tal forma que la ecuación de combustión teórica ideal es
![]()
La cantidad de reactivos se obtiene del balance estequiométrico ideal
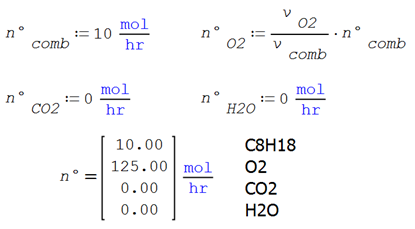
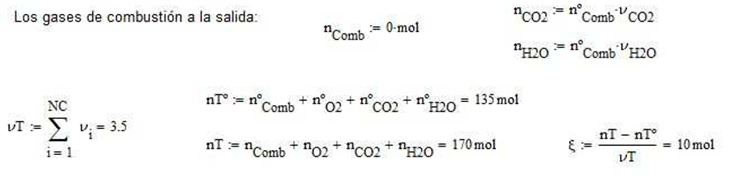
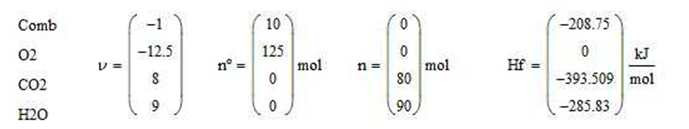
Calor de reacción estándar a 298K por mol de combustible alimentado
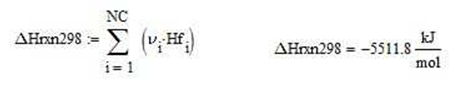
La temperatura máxima alcanzada o de llama adiabática

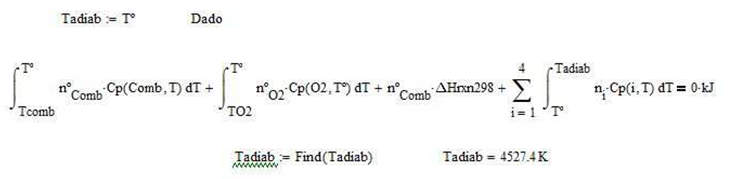
Calor extraído para
alcanzar una temperatura de producto dada a la salida
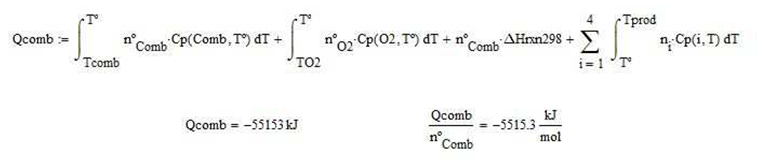
La temperatura de los productos a la salida cuando de extrae una cantidad conocida de calor
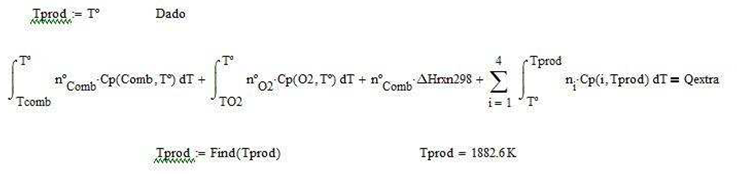
Caso 2. Se alimenta un combustible puro y se hace reaccionar con aire seco. En este caso el aire puede agregarse en exceso para garantizar una combustión completa.
Son sistemas reactivos menos eficientes, pero representan el común de las operaciones industriales de este tipo. En estos casos puede haber presencia de monóxido de carbono a la salida, como producto de mezclas no perfectas de combustión. Se ilustra el procedimiento
Ilustración 4.5. Se utiliza un horno de combustión que opera a 1 atm, para quemar 10 mol/hr de octano puro utilizando ire seco a 25°C el cual se alimenta en un 30% en exceso. Se reporta a la salida 91.93% de CO2 y el resto de CO.
Evaluar:
a)
La temperatura de llama adiabática
b)
El calor extraído cuando la temperatura de los gases de combustión es 250°C
c)
La temperatura de salida de los gases cuando se extraen 3,500 kJ/hr de calor
Solución.
![]()
Cálculo del balance estequiométrico a partir de las reacciones de combustión teóricas ideales
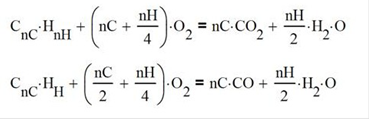
Ocurren dos reacciones en paralelo, produciendo CO2 y CO y las relaciones estequiométricas teóricas son
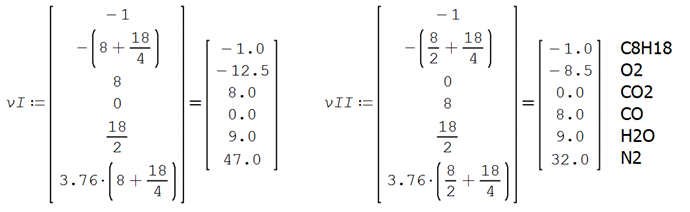
En base a la estequiometría, las dos reacciones integradas por mol de combustible alimentado son
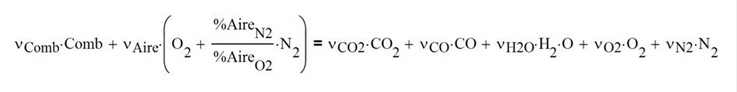
Los coeficientes estequiométricos incluyendo el aire en exceso son

Los moles de combustibles y aire a la entrada son

La cantidad de gases de combustión a la salida es

El calor de combustión estándar (298K) a la salida es
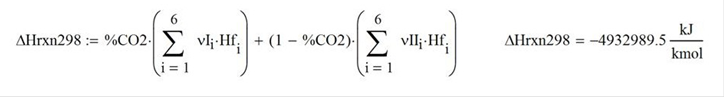
La temperatura de llama adiabática

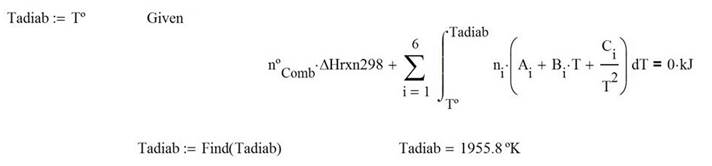
El calor extraído para alcanzar una temperatura conocida del producto a la salida


La temperatura de los productos a la salida cuando se extrae una cantidad conocida de calor Q = -3,500 kJ
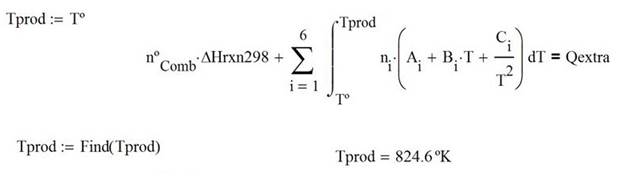
Caso 3. Se alimenta un combustible puro, el cual se puede precalentar para mejorar la eficiencia de combustión, y se hace reaccionar con aire, que se agrega en exceso, el cual a su vez puede contener humedad.
Se obtiene la información de las concentraciones de los gases de combustión por el análisis ORSAT.
Son sistemas reactivos mucho menos eficientes, con presencia de monóxido de carbono, resultado de la presencia de humedad en el aire entre otras causas. Se presenta una ilustración al respecto en donde se muestra lo complejo que pueden llegar a ser los cálculos.
Ilustración 4.6. Se utiliza un horno de combustión que opera a 1 atm, para quemar 10 mol/hr de octano puro precalentado a 35°C, utilizando aire a 25°C el cual se alimenta en un 30% en exceso y contiene una humedad relativa del 75%. Se reporta el análisis de chimenea ORSAT de 10.02% CO2, 0.88% CO, 5.62% O2 y 83.48% N2.
Evaluar:
a)
La temperatura de llama adiabática
b)
El calor extraído cuando la temperatura de los gases de combustión es 250°C
c)
La temperatura de salida de los gases cuando se extraen 3,500 kJ/hr de calor

Los gases de combustión ORSAT sirven para determinar la relación en peso de bióxido formado con respecto al total de bióxido y monóxido juntos
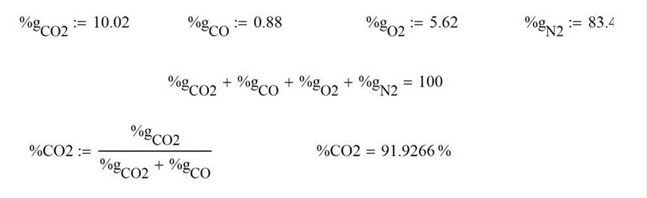
Las reacciones de combustión teóricas ideales planteadas en la ilustración anterior y el cálculo del balance estequiométrico es


En base a la estequiometría, las dos reacciones integradas por mol de combustible alimentado son

Los coeficientes estequiométricos que incluyen el aire en exceso son iguales a los planteadas en la ilustración anterior, de tal forma que los moles de combustibles y aire a la entrada coinciden con los valores hallados previo.

La cantidad de gases de combustión a la salida es

El aire seco teórico corresponde a
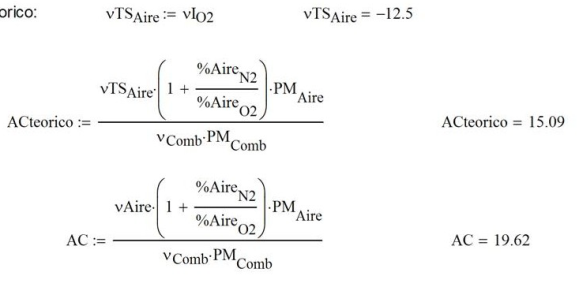
Convirtiendo los moles a la salida en términos másicos

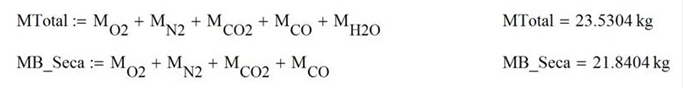
La humedad absoluta a la salida del quemador


El calor de combustión estándar a la salida (298K) por mol de combustible alimentado es
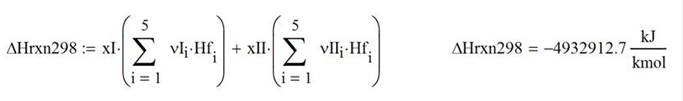
La temperatura de llama adiabática

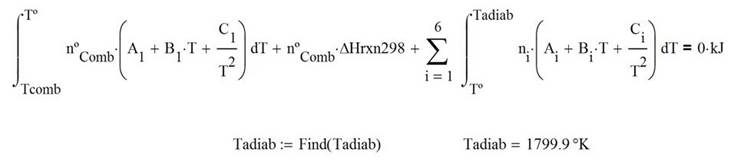
Calor extraído para alcanzar una temperatura conocida del producto a la salida
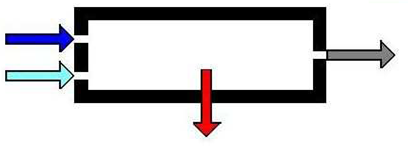

La temperatura de los productos a la salida cuando se extrae una cantidad conocida de calor--Q = -3,500 kJ
Se incluye en al anexo 06 la codificación en SMathSolver de esta ilustración.
4. Criterio de Equilibrio en Reacción Química.
 Para un sistema reactivo a presión y temperatura constante,
al combinar la primera y segunda ley termodinámica, se obtiene la expresión de
energía libre de Gibbs
Para un sistema reactivo a presión y temperatura constante,
al combinar la primera y segunda ley termodinámica, se obtiene la expresión de
energía libre de Gibbs
dGT,P
= dU + P dV - T dS ≤ 0 (4.14)
La reacción a temperatura y presión
especificadas, se desplaza en la dirección de la disminución de la función de
Gibbs, y la reacción se detiene cuando alcanza un mínimo en el valor de esta
función. Este es el criterio de equilibrio químico
![]() (4.15)
(4.15)
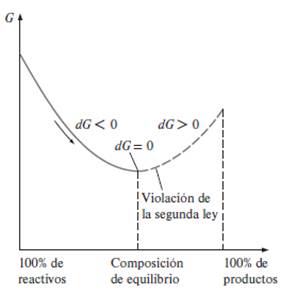
Podemos
ver este comportamiento en la figura (Cengel et al,
2022:793) en donde se muestra esta tendencia al equilibrio ya que la reacción
se amortigua y detiene al llegar a cero el cambio en el valor de la función de
Gibbs.
Aplicando
este criterio a una reacción química en base a los coeficientes
estequiométricos, el avance de reacción y la función de Gibbs de cada
componente, se obtiene la siguiente expresión conocida como el criterio de
equilibrio de reacción
![]() (4.16)
(4.16)
en
donde νi
son los coeficientes estequiométricos
Gi
es la energía libre parcial molar de Gibbs de cada reactante
Esta
ecuación es de aplicación sin importar la fase en que transcurra la reacción. La
energía libre de Gibbs para un sistema reactivo gaseoso cerrado queda definida
por la expresión
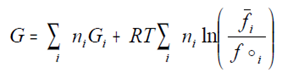 (4.17)
(4.17)
en
donde Gi es la energía de
Gibbs de cada componente puro
ni
los moles de cada especie reactante
fi
y foi son las fugacidades de
cada especie en la mezcla y como sustancia pura a T y P del sistema
Para
un sistema gaseoso a baja presión se puede considerar la idealidad por medio de
la expresión
![]() (4.18)
(4.18)
A
medida que la reacción transcurre el número de moles, reflejado en las fracciones
molares de cada especie, y la energía libre de Gibbs total cambian. El número
de moles de todas las especies está relacionado entre si a través de la
coordenada de reacción ya definida previo
![]() (4.02)
(4.02)
De tal
forma que
![]() (4.19)
(4.19)
Esta expresión es muy útil, ya que
solamente se tiene una variable a determinar.
Ilustración 4.7. La siguiente reacción
en fase gaseosa ocurre en un sistema cerrado a presión y temperatura constantes,
inicialmente 1 mol de CO2 y 1 mol de H2.
![]()


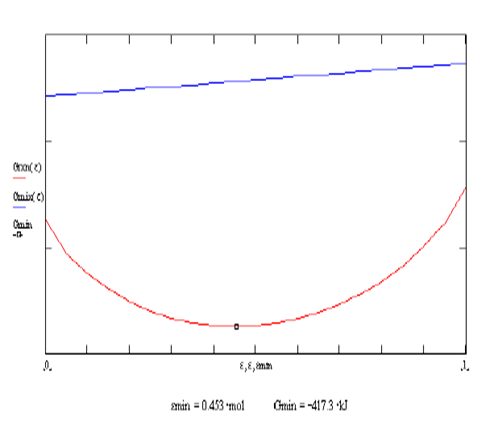
Se
incluye en al anexo 07 la codificación en SMathSolver de esta ilustración
4.1. Energía
de Gibbs y Constante de Equilibrio
Se define la actividad química de la
especie i en una mezcla reactiva como la relación de fugacidades en i
mezcla y como sustancia pura en el estado estándar.
El potencial químico de mezcla en
términos de la actividad química de mezcla se expresa así
![]() (4.20)
(4.20)
Y para la condición de equilibrio se
tiene la siguiente igualdad
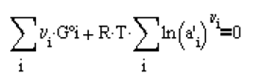 (4.21)
(4.21)
Por otra parte, la variación de la función
de Gibbs a la temperatura de la mezcla y 1 atm de presión se expresa como
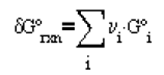 (4.22)
(4.22)
Por definición, la constante de
equilibrio en términos de la actividad química de mezcla es
![]() (4.23)
(4.23)
Para el caso de gases ideales la
ecuación anterior se simplifica a
![]() (4.24)
(4.24)
Y por la definición de la fugacidad de
mezcla de obtiene
![]() (4.25)
(4.25)
Ilustración 4.8. Calcule el avance
de reacción para la dimerización del tetraóxido de nitrógeno
![]()
Data:
temperatura, presión y función de Gibbs de formación

Cálculo de la función de Gibbs
estándar
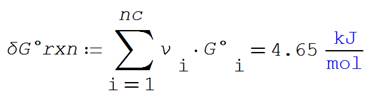
La constante de equilibrio estándar
vale
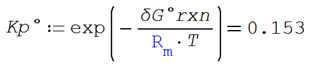
Calculando por medio de la fórmula
de Kp en función de la presión y el avance de
reacción
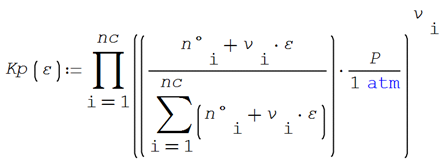
De la estequiometría de
reacción aplicando el avance de reacción tenemos
![]()
![]()
![]()
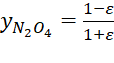
![]()
Y trasladando estos
valores a la expresión de Kp tenemos
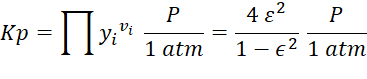
El criterio de equilibrio indica que
se debe igualar el valor de Kp°(T) y Kp(P) para determinar el avance efectivo de reacción. Por
tanteos se puede resolver
![]()
Alternativamente, se puede utilizar
la ec. 4.19 de la función de Gibbs en términos del
avance
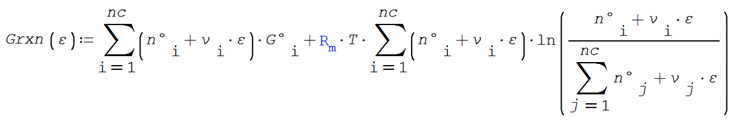
Que al sustituir las composiciones y
en términos del avance queda
![]()

Se define la derivada de la función de
Gibbs
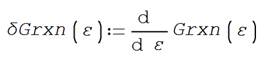
para determinar su valor igual a
cero que coincide con el valor menor de Gibbs, es decir en ε de equilibrio
![]()
Que coincide con el valor encontrado
en la sección anterior.
Se
incluye en al anexo 04 la codificación en SMathSolver de esta ilustración
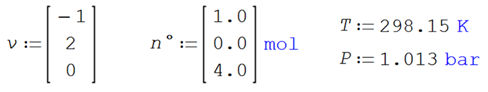
Ilustración 4.9. Para la misma
dimerización del tetraóxido de nitrógeno, se adiciona un gas inerte en relación
5:1
![]()
Data: temperatura, presión y función
de Gibbs de formación
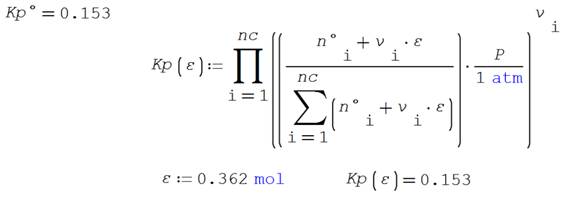
Puede observarse que se favorece el
avance de reacción al adicionar un gas inerte. Se incluye en al anexo 04 la codificación en SMathSolver de esta
ilustración
4.2.
Cálculo
de la Constante de Equilibrio con la temperatura
El efecto de cambios
en la temperatura en una reacción química se ve reflejado en la constante de equilibrio [K], la cual puede ser evaluada a
partir de la Ecuación de Van`t Hoff
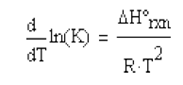 (4.26)
(4.26)
Integrando se obtiene la expresión que relaciona dos estados de
equilibrio:
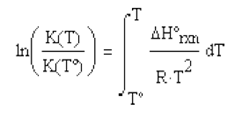 (4.27)
(4.27)
Para intervalos de temperatura pequeños, se puede hacer una aproximación
de la ecuación anterior
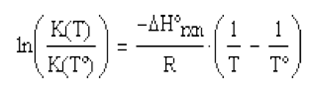 (4.28)
(4.28)
Ilustración 4.10. Calcule el avance de reacción para la
dimerización del tetraóxido de nitrógeno puro para intervalos de temperatura
entre 200 y 400K a presiones de 0.1, 1.0 y 10 atmósferas
![]()
Data
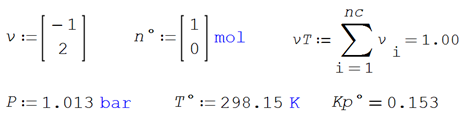
Entalpía de formación y
coeficientes de la capacidad calorífica

La entalpía de reacción se puede expresar en función de la
temperatura en forma integrada
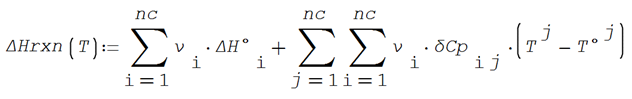
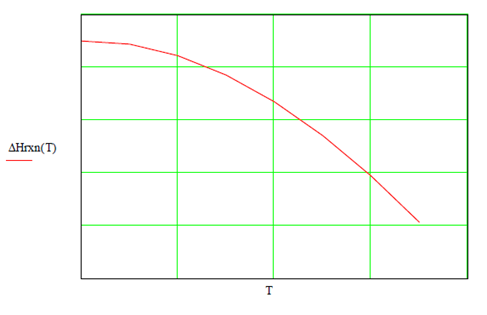
Graficando la entalpía de reacción para rangos de temperatura se
observa disminución en su valor, lo cual indica que el calor liberado será
menor conforme aumenta la temperatura del sistema reactivo.
Por otra parte, utilizando la ecuación de van´t
Hoff
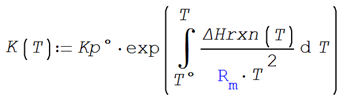
Utilizando la expresión de Kp
desarrollada en la ilustración (4.2) y despejando para el avance
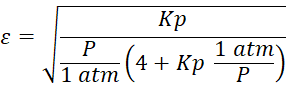
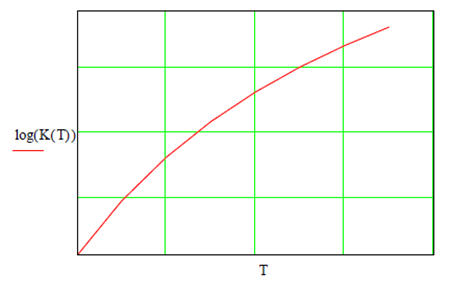
Al graficar el avance de reacción en función de la temperatura se
observa un incremento en la dimerización del óxido. A mayor pendiente indica
velocidad de reacción mayor
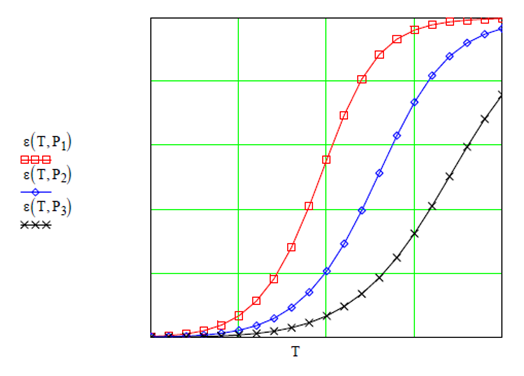
Al inicio la reacción procede despacio hasta llegar a la
temperatura de máxima velocidad que corresponde a la sección de pendiente
máxima en la figura. Sin embargo, hay una temperatura límite a la cual esa
tendencia disminuye drásticamente hasta detenerse la reacción, lográndose el
equilibrio. Esta misma tendencia ocurre para diferentes isóbaras, aunque a
mayor presión se amortigua la reacción y es más lento el avance.
Se incluye en al anexo 11 la codificación en SMathSolver de esta
ilustración
4.3. Sistemas
de Reacciones Múltiples
Se
pueden evaluar las condiciones de equilibrio en mezclas de especies gaseosas por
medio del cálculo de las composiciones finales en términos de la energía Libre de
Gibbs de formación de cada componente:
![]()
en
donde aik es una matriz de frecuencia de atomos presentes en cada especie y λk
son multiplicadores de Lagrange para resolver el sistema de ecuaciones. Se utilizan
las masas atómicas y se resuelve para las fracciones molares.
Se puede entonces, obtener el avance relativo de las reacciones en competencia. Por ejemplo:
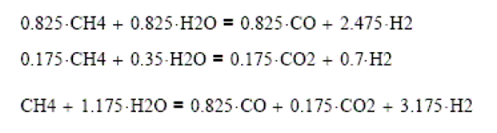
Cuando se conocen las reacciones del sistema reactivo se procede a plantear funciones de la entalpia de reacción como función de la temperatura, aplicando el criterio sugerido por Smith, van Ness y Abbott. Seguidamente por la ecuación de van`t Hoff se obtienen expresiones para las constantes de equilibrio en función de la temperatura, el calor de reacción y la constante de equilibrio estándar para cada reacción.
Ilustración 4.12. Para el sistema de reacciones dado, encuentre los valores de las Constantes de Equilibrio Termodinámico para un intervalo de temperatura de 600 a 1600°K a 1 atm constante. Evaluar las fracciones molares a 600°K asumiendo 1 mol inicial de agua en la fase gaseosa.
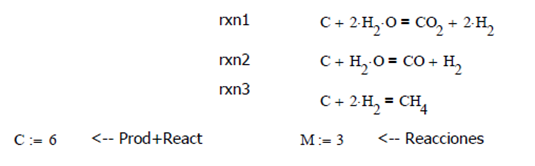
Data

Evaluando
las Constantes Termodinámicas Estándar
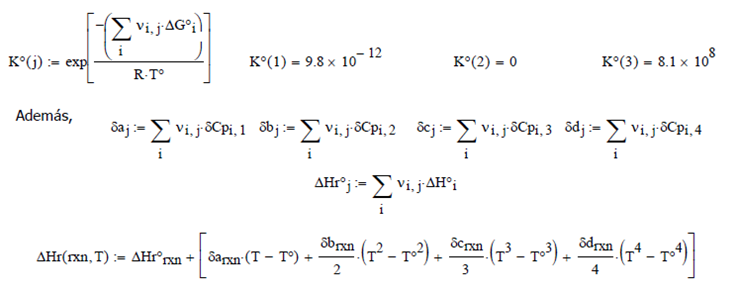
Aplicando
la ecuación de van't Hoff
(Ec.15.16 Smith, van Ness & Abbott)
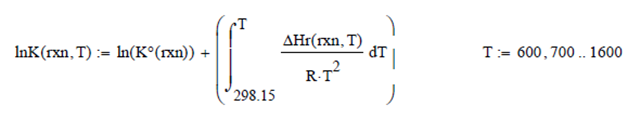
Efectuando un Balance de Masa para el sistema de ecuaciones, asumiendo las coordenadas de reacción ε1, ε2 y ε3 respectivamente, para 1 mol de vapor de agua inicial, se obtienen las expresiones
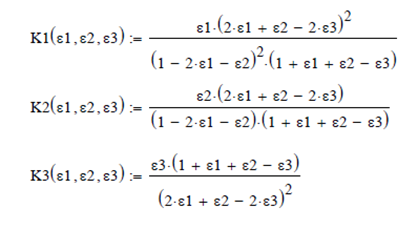
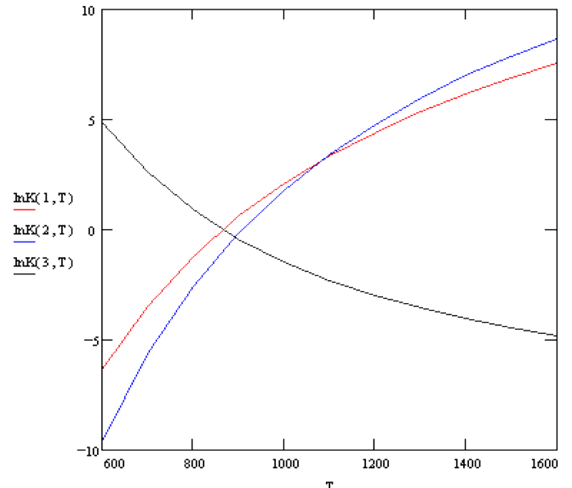
Buscando la temperatura a la cual K2 = K3
Tcom = 600K
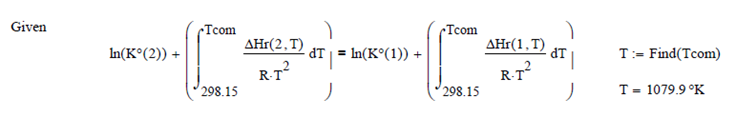
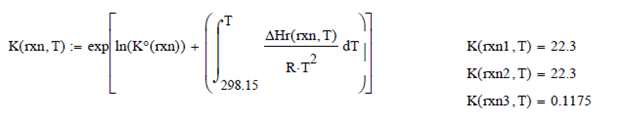
Evaluando la Coordenada de Reacción a
esa temperatura
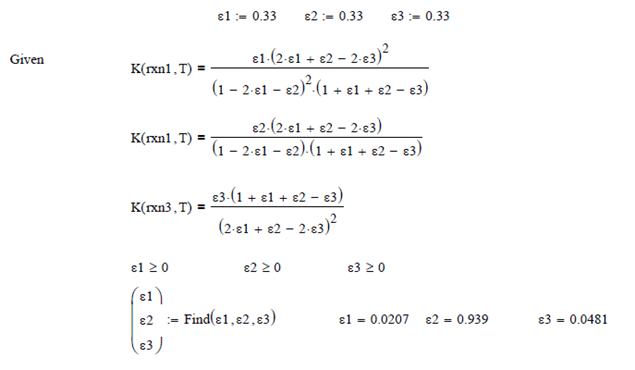
Para
determinar las fracciones molares a esa temperatura T = 1079.9K

Ref.
Sandler, Stanley I. (1999). "Chemical
and Engineering Thermodynamics". Third Edition.
John Wiley & Sons. New York. pp. 678-680
Ilustración 4.12. Calcular las composiciones de equilibrio a 1,000K y 1 bar
del sistema reactivo gaseoso que contiene metano, agua, monóxido y bióxido de
carbono e hidrógeno. Al inicio están presentes 2 moles de metano y 3 moles de
agua.
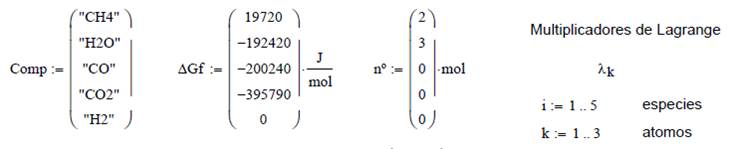
Para resolver este problema es
necesario realizar un balance de masa atómico, y por el número de variables se
emplean multiplicadores de Lagrange
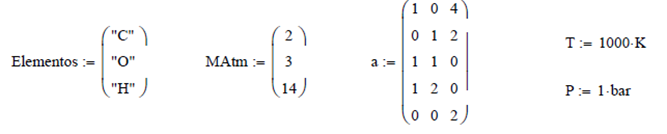
![]()
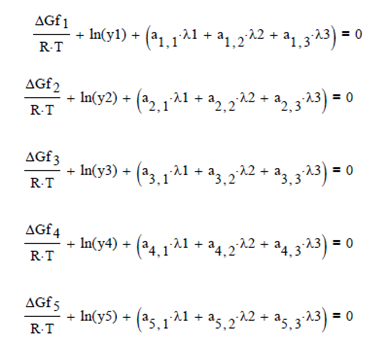
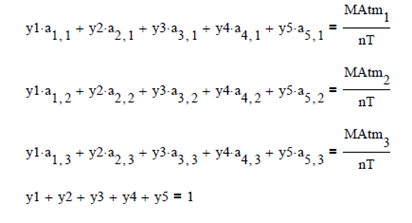
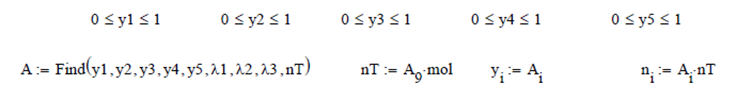
Los
moles y las fracciones molares finales de la mezcla son

Cálculo
del avance de reacción y coeficientes estequiométricos
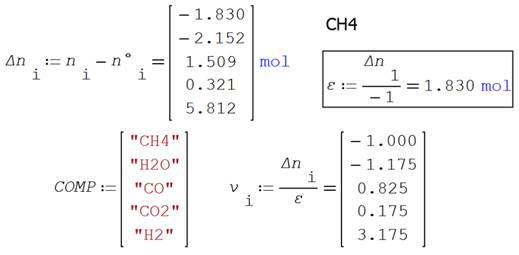
Las reacciones
en este sistema son

La
reacción incompleta de CO avanza un 82.5% y la del CO2 solamente
17.5%.
SMITH,
J.M.; VAN NESS, H.C.; ABBOTT, M.M. (2005). "Introduction to Chemical
Engineering Thermodynamics". Seventh Edition. McGraw Hill's Series:
Chemical Engineering Series. New York. pp 527-528; 693
ANEXOS
ANEXO 01. Codificación en SMathSolver de la Ilustración
4.1 con la interfase a Excel para graficar


ANEXO 02. Ilustración 4.2. codificación en SMathSolver
ANEXO 03. Ilustración 4.3. codificación en SMathSolver
ANEXO 04. Ilustración 4.8, 4.9, 4.10. codificación en SMathSolver